Problema envolvendo Mol
2 participantes
Página 1 de 1
 Problema envolvendo Mol
Problema envolvendo Mol
(UECE) A fórmula empírica de um composto orgânico de massa 0,86g formado apenas de carbono, hidrogênio e oxigênio e que, através de uma combustão completa, produz 2,20g de CO2 e 0,9g de H20 é:
a)C4 H10 O
b)C5 H10 O
c)C4 H8 O
d)C5 H12 O
a)C4 H10 O
b)C5 H10 O
c)C4 H8 O
d)C5 H12 O

LeoGuanda- Padawan

- Mensagens : 60
Data de inscrição : 29/05/2016
Idade : 23
Localização : São José do Rio Preto, São Paulo, Brasil
 Re: Problema envolvendo Mol
Re: Problema envolvendo Mol
Olá, boa noite
Primeiro faça o cálculo da quantidade de Carbono e Hidrogênio formada nos produtos, como sabemos que essas quantidades vieram do composto em questão, podemos achar a quantidade de oxigênio no mesmo e assim determinar a fórmula empírica. Segue:
Carbono:

Hidrogênio:
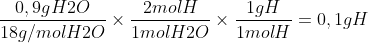
Cálculo da massa de Oxigênio no composto em questão:
0,86 - 0,6 - 0,1 = 0,16 g O
Cálculo da quantida de mols de cada elemento:
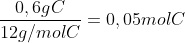
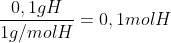
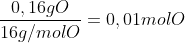
Agora que já temos a proporção em mols, basta fazer com que esses números sejam inteiros, então divida pelo menor
0,05 / 0,01 = 5 mols de Carbono
0,1 / 0,01 = 10 mols de Hidrogênio
0,01/0,01 = 1 mol de Oxigênio
Portanto a fórmula empírica do composto pedido é C5H10O

Primeiro faça o cálculo da quantidade de Carbono e Hidrogênio formada nos produtos, como sabemos que essas quantidades vieram do composto em questão, podemos achar a quantidade de oxigênio no mesmo e assim determinar a fórmula empírica. Segue:
Carbono:
Hidrogênio:
Cálculo da massa de Oxigênio no composto em questão:
0,86 - 0,6 - 0,1 = 0,16 g O
Cálculo da quantida de mols de cada elemento:
Agora que já temos a proporção em mols, basta fazer com que esses números sejam inteiros, então divida pelo menor
0,05 / 0,01 = 5 mols de Carbono
0,1 / 0,01 = 10 mols de Hidrogênio
0,01/0,01 = 1 mol de Oxigênio
Portanto a fórmula empírica do composto pedido é C5H10O
igorrudolf- Jedi

- Mensagens : 434
Data de inscrição : 10/09/2014
Idade : 28
Localização : São Paulo - São Paulo
 Tópicos semelhantes
Tópicos semelhantes» Problema envolvendo mmc
» Problema envolvendo mmc
» problema envolvendo mmc/mdc
» Problema envolvendo mmc
» Problema envolvendo PA e PG
» Problema envolvendo mmc
» problema envolvendo mmc/mdc
» Problema envolvendo mmc
» Problema envolvendo PA e PG
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













