estequiometria . questao uerj
3 participantes
Página 1 de 1
 estequiometria . questao uerj
estequiometria . questao uerj
Em nosso organismo, parte da energia liberada pela oxidação completa da glicose é captada na reação ADP+FosfatoëATP Considere que: - em pessoas sadias, parte da energia liberada pela oxidação completa de 1mol de glicose acumula-se sob a forma de 38mols de ATP, sendo a energia restante dissipada sob forma de calor; - em um determinado paciente com hipertireoidismo, o rendimento de produção de ATP foi 15% abaixo do normal; - a reação de hidrólise ATPëADP+Fosfato libera 7.000cal/mol. A quantidade de calor que o paciente com hipertireoidismo libera a mais que uma pessoa sadia, nas mesmas condições, quando oxida completamente 1,0mol de glicose, é, em kcal, aproximadamente igual a:
a) 40
b) 61
c) 226
d) 266
a) 40
b) 61
c) 226
d) 266
maria isabel fernandes- Padawan

- Mensagens : 50
Data de inscrição : 01/01/2015
Idade : 30
Localização : Santa Rosa do Purus, AC, Brasil
 Re: estequiometria . questao uerj
Re: estequiometria . questao uerj
Vamos lá, Maria Isabel, parte por parte:
Uma reação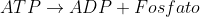 libera 7kcal.
libera 7kcal.
Em uma pessoa normal nós temos o seguinte:
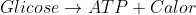
Como um mol de glicose reage com 38 mols de ATP, nós temos que um mol de glicose produzirá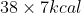 (pois cada molécula de ATP armazena 7kcal, e uma de glicose reage com 38), o que resulta em 266kcal
(pois cada molécula de ATP armazena 7kcal, e uma de glicose reage com 38), o que resulta em 266kcal
Sabendo disso, de que uma pessoa com hipertireoidismo perde 15% da produção de ATP, e de que ela libera essa porcentagem como calor, basta realizarmos a seguinte regra de três:
266kcal -------- 100%
x --------------- 15%
Cujo resultado é 39,9kcal. Temos, portanto, como resultado, a alternativa A.
Att: Christian.
Uma reação
Em uma pessoa normal nós temos o seguinte:
Como um mol de glicose reage com 38 mols de ATP, nós temos que um mol de glicose produzirá
Sabendo disso, de que uma pessoa com hipertireoidismo perde 15% da produção de ATP, e de que ela libera essa porcentagem como calor, basta realizarmos a seguinte regra de três:
266kcal -------- 100%
x --------------- 15%
Cujo resultado é 39,9kcal. Temos, portanto, como resultado, a alternativa A.
Att: Christian.
 Re: estequiometria . questao uerj
Re: estequiometria . questao uerj
Valeu Christian, voe explicou muito bem .
maria isabel fernandes- Padawan

- Mensagens : 50
Data de inscrição : 01/01/2015
Idade : 30
Localização : Santa Rosa do Purus, AC, Brasil
 Re: estequiometria . questao uerj
Re: estequiometria . questao uerj
1 mol de glicose -> 38 ATPs + calor (sadia)
1 mol de glicose -> 38 * 0,85 + calor (hipertireoidismo)
Para hipertireoidismo foi gerado menos ATP, ou seja, mais calor produzido. Que vem da diferença de rendimento. Para normal, temos 38 * 7kcal em ATP, ou seja, não gera calor. Em hipertireoidismo, temos 38 * 7kcal * 0,85 em ATP, ou seja, não gera calor. Como essa diferença de energia armazenada em ATP foi liberada na forma de calor, temos calor a mais do hipertireoidismo. 38 * 7kcal - 38 * 7kcal * 0,85= 38 * 7kcal * 0,15 = 40kcal
Letra A) 40kcal
1 mol de glicose -> 38 * 0,85 + calor (hipertireoidismo)
Para hipertireoidismo foi gerado menos ATP, ou seja, mais calor produzido. Que vem da diferença de rendimento. Para normal, temos 38 * 7kcal em ATP, ou seja, não gera calor. Em hipertireoidismo, temos 38 * 7kcal * 0,85 em ATP, ou seja, não gera calor. Como essa diferença de energia armazenada em ATP foi liberada na forma de calor, temos calor a mais do hipertireoidismo. 38 * 7kcal - 38 * 7kcal * 0,85= 38 * 7kcal * 0,15 = 40kcal
Letra A) 40kcal

danielfogao- Recebeu o sabre de luz

- Mensagens : 165
Data de inscrição : 05/01/2019
 Tópicos semelhantes
Tópicos semelhantes» uerj -estequiometria
» UERJ -Estequiometria Hemoglobina
» UERJ - Química (Estequiometria)
» Questão ada UERJ
» questão Uerj
» UERJ -Estequiometria Hemoglobina
» UERJ - Química (Estequiometria)
» Questão ada UERJ
» questão Uerj
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













