Gases
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Gases
Gases
O fator de compressibilidade (z) pode ser definido como
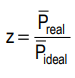
em que P é a pressão exercida por um mol de moléculas de gás. Pede-se:
a) Substituindo Preal pela equação de van der Waals e Pideal pela equação de Clapeyron na expressão do fator de compressibilidade, determine uma expressão para z em função do volume V, da constante dos gases R, da temperatura T e das constantes de van der Waals a e b.
b) A temperatura de Boyle é a temperatura para o qual o gás tem o seu comportamento mais ideal. Sabendo que para situações de idealidade o volume das moléculas é bem menor que o volume do recipiente, determine a expressão da temperatura de Boyle em função das constante de van der Waals e da constante dos gases.
c) Considere um gás X com as constantes de van der Waals a = 1,21 atm L² / mol² e b = 0,1L / mol . Determine a pressão que 1 mol desse gás exerce em um recipiente de 1,1 L, a 127º C.
d) Para o gás do item anterior, determine a temperatura de Boyle.
e) Ainda para o gás do item c), determine se, para aumentar a sua idealidade a partir da temperatura ambiente, é necessário aumentar ou diminuir a sua temperatura. Justifique com o gráfico de z em função da pressão para diferentes temperaturas.
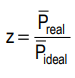
em que P é a pressão exercida por um mol de moléculas de gás. Pede-se:
a) Substituindo Preal pela equação de van der Waals e Pideal pela equação de Clapeyron na expressão do fator de compressibilidade, determine uma expressão para z em função do volume V, da constante dos gases R, da temperatura T e das constantes de van der Waals a e b.
b) A temperatura de Boyle é a temperatura para o qual o gás tem o seu comportamento mais ideal. Sabendo que para situações de idealidade o volume das moléculas é bem menor que o volume do recipiente, determine a expressão da temperatura de Boyle em função das constante de van der Waals e da constante dos gases.
c) Considere um gás X com as constantes de van der Waals a = 1,21 atm L² / mol² e b = 0,1L / mol . Determine a pressão que 1 mol desse gás exerce em um recipiente de 1,1 L, a 127º C.
d) Para o gás do item anterior, determine a temperatura de Boyle.
e) Ainda para o gás do item c), determine se, para aumentar a sua idealidade a partir da temperatura ambiente, é necessário aumentar ou diminuir a sua temperatura. Justifique com o gráfico de z em função da pressão para diferentes temperaturas.
- Spoiler:
- a) z = v/(V - b) - a/VRT b) T = a/bR c) 31,8 atm d) 147,5K e) Diminuir a temperatura
Nycolas- Padawan

- Mensagens : 64
Data de inscrição : 19/01/2023
Idade : 19
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













