Atomística
2 participantes
Página 1 de 1
 Atomística
Atomística
Dado: espectro eletromagnético
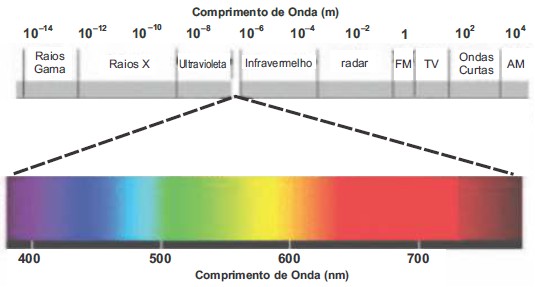
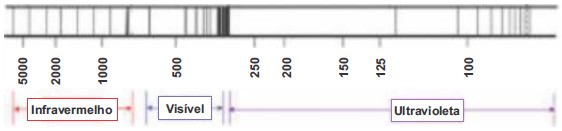
O espectro de emissão do hidrogênio apresenta uma série de linhas na região do ultravioleta, do visível e no infravermelho próximo, como ilustra a figura a seguir.
Niels Bohr, físico dinamarquês, sugeriu que o espectro de emissão do hidrogênio está relacionado às transições do elétron em determinadas camadas. Bohr calculou a energia das camadas da eletrosfera do átomo de hidrogênio, representadas no diagrama de energia a seguir. Além disso, associou as transições eletrônicas entre a camada dois e as camadas de maior energia às quatro linhas observadas na região do visível do espectro do hidrogênio.

Um aluno encontrou um resumo sobre o modelo atômico elaborado por Bohr e o espectro de emissão atômico do hidrogênio contendo algumas afirmações.
I. A emissão de um fóton de luz decorre da transição de um elétron de uma camada de maior energia para uma camada de menor energia.
II. As transições das camadas 2, 3, 4, 5 e 6 para a camada 1 correspondem às transições de maior energia e se encontram na região do infravermelho do espectro.
III. Se a transição 3→2 corresponde a uma emissão de cor vermelha, a transição 4→2 está associada a uma emissão violeta e a 5→2 está associada a uma emissão verde.
Pode-se afirmar que está(ão) correta(s):
a) I, somente
b)I e II, somente
c) I e III, somente
d) II e III, somente
Gabarito: A
Não sei como verificar se II e III estão certas ou erradas.

O espectro de emissão do hidrogênio apresenta uma série de linhas na região do ultravioleta, do visível e no infravermelho próximo, como ilustra a figura a seguir.

Niels Bohr, físico dinamarquês, sugeriu que o espectro de emissão do hidrogênio está relacionado às transições do elétron em determinadas camadas. Bohr calculou a energia das camadas da eletrosfera do átomo de hidrogênio, representadas no diagrama de energia a seguir. Além disso, associou as transições eletrônicas entre a camada dois e as camadas de maior energia às quatro linhas observadas na região do visível do espectro do hidrogênio.

Um aluno encontrou um resumo sobre o modelo atômico elaborado por Bohr e o espectro de emissão atômico do hidrogênio contendo algumas afirmações.
I. A emissão de um fóton de luz decorre da transição de um elétron de uma camada de maior energia para uma camada de menor energia.
II. As transições das camadas 2, 3, 4, 5 e 6 para a camada 1 correspondem às transições de maior energia e se encontram na região do infravermelho do espectro.
III. Se a transição 3→2 corresponde a uma emissão de cor vermelha, a transição 4→2 está associada a uma emissão violeta e a 5→2 está associada a uma emissão verde.
Pode-se afirmar que está(ão) correta(s):
a) I, somente
b)I e II, somente
c) I e III, somente
d) II e III, somente
Gabarito: A
Não sei como verificar se II e III estão certas ou erradas.
Henrique0101.- Iniciante
- Mensagens : 2
Data de inscrição : 05/12/2022
 Re: Atomística
Re: Atomística
para descobrir a veracidade dos itens II e III é preciso você utilizar conservação de energia...
Quando é passado de um nível de energia de maior para o menor, há a emissão de um fóton, precisamos calcular as energias dos fótons liberados para cada processo que ele menciona, por exemplo no item III o enunciado fala sobre a transição de 3 para 2:
Energia, 3 - Energia, 2 = Energia do fóton = h.f
Onde h -> constante de Planck e f -> frequência
- 1,51 - (- 3,4) = h.c/lambda
c -> velocidade da luz
transformando para Joule o eV, apenas multiplicando por 1,6.10^-19
(1,89).(1,6.10^-19) = (6,6.10^-34).3.10^8/lambda
lambda = 6.54.10^-7 m -> lambda = 654 nm (aproximadamente)
Que corresponde a cor vermelha, agora tem que fazer as outras pelo mesmo processo para descobrir qual está errado...
Confio em você para terminar
Quando é passado de um nível de energia de maior para o menor, há a emissão de um fóton, precisamos calcular as energias dos fótons liberados para cada processo que ele menciona, por exemplo no item III o enunciado fala sobre a transição de 3 para 2:
Energia, 3 - Energia, 2 = Energia do fóton = h.f
Onde h -> constante de Planck e f -> frequência
- 1,51 - (- 3,4) = h.c/lambda
c -> velocidade da luz
transformando para Joule o eV, apenas multiplicando por 1,6.10^-19
(1,89).(1,6.10^-19) = (6,6.10^-34).3.10^8/lambda
lambda = 6.54.10^-7 m -> lambda = 654 nm (aproximadamente)
Que corresponde a cor vermelha, agora tem que fazer as outras pelo mesmo processo para descobrir qual está errado...
Confio em você para terminar

Matheus Tsilva- Fera

- Mensagens : 1167
Data de inscrição : 16/07/2015
Idade : 25
Localização : Uberaba, MG
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













