Equilíbrio químico
3 participantes
Página 1 de 1
 Equilíbrio químico
Equilíbrio químico
A "chuva ácida" é uma característica de regiões industrializadas.Supondo que o único responsável por tal acidez seja o ácido sulfúrico, calcule a concentração de enxofre, em mg/l, de uma chuva cujo pH seja 4,0.Massa atômica: S=32
Então, minha dúvida é...
Considero que a dissociação é a seguinte:
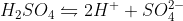
Por que ele não usa a primeira dissociação
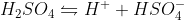
- Spoiler:
- 1.6 mg S/l
Então, minha dúvida é...
Considero que a dissociação é a seguinte:
Por que ele não usa a primeira dissociação
Agash- Recebeu o sabre de luz

- Mensagens : 127
Data de inscrição : 26/07/2011
Idade : 32
Localização : Urca,Rio de Janeiro, Brasil
 Re: Equilíbrio químico
Re: Equilíbrio químico
olá, Agash
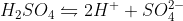
pH=4 >> [H+]=10-4mol/L
2 mol/L [H+] --------------->>> 1 mol/L S
10-4mol/L ----------------->>> x
x=0,5*10-4mol/L de S
1 mol/L de S --------------------------->>> 32g/L S
0,5*10-4mol/L --------->> y
y=16*10-4g/L
y=1,6mg de enxofre
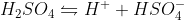
se não estou enganado, essa é a equação de dissociação parcial
pH=4 >> [H+]=10-4mol/L
2 mol/L [H+] --------------->>> 1 mol/L S
10-4mol/L ----------------->>> x
x=0,5*10-4mol/L de S
1 mol/L de S --------------------------->>> 32g/L S
0,5*10-4mol/L --------->> y
y=16*10-4g/L
y=1,6mg de enxofre
se não estou enganado, essa é a equação de dissociação parcial

killua05- Jedi

- Mensagens : 296
Data de inscrição : 15/04/2011
Idade : 32
Localização : São Paulo
 Re: Equilíbrio químico
Re: Equilíbrio químico
se não estou enganado, essa é a equação de dissociação parcial
É isso mesmo Killua05, essa é a dissociação parcial.
E para efeito de determinação do Ph ou concentração, deve-se considerar a dissociação total, a menos que seja requerido pelo exercício que se determine levando em conta apenas a 1° dissociação.
 Tópicos semelhantes
Tópicos semelhantes» Equilibrio Quimico
» Equilíbrio Químico
» EQUILIBRIO QUIMICO
» Equilíbrio Químico
» Equilibrio quimico
» Equilíbrio Químico
» EQUILIBRIO QUIMICO
» Equilíbrio Químico
» Equilibrio quimico
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












