EQUILIBRIO QUIMICO
2 participantes
Página 1 de 1
 EQUILIBRIO QUIMICO
EQUILIBRIO QUIMICO
Em um recipiente de 10 litros são introduzidos 440g de anidrido carbônico que vão se decompondo de acordo com a equação:
A evolução do processo é retratada pelo gráfico a seguir, sendo o equilíbrio atingido numa temperatura X.
Após a análise gráfica podemos afirmar que:
A a constante de equilíbrio Kc é igual a 18.
B a constante de equilíbrio Kc é igual a 0,18.
C a elevação da temperatura aumenta a velocidade da reação no sentido 2.
D a elevação da temperatura diminui o valor da constante de equilíbrio.
E o rendimento da reação inversa é 80%.

A evolução do processo é retratada pelo gráfico a seguir, sendo o equilíbrio atingido numa temperatura X.
Após a análise gráfica podemos afirmar que:
A a constante de equilíbrio Kc é igual a 18.
B a constante de equilíbrio Kc é igual a 0,18.
C a elevação da temperatura aumenta a velocidade da reação no sentido 2.
D a elevação da temperatura diminui o valor da constante de equilíbrio.
E o rendimento da reação inversa é 80%.

douglasfreireac- Iniciante
- Mensagens : 45
Data de inscrição : 17/08/2012
Idade : 30
Localização : Rio Branco/Ac
 Re: EQUILIBRIO QUIMICO
Re: EQUILIBRIO QUIMICO
Olá Douglas,
Primeiramente vamos calcular a molaridade incial do anidrido carbônico presente no recipiente
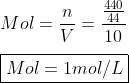
Início da reação há:
} \ \ ; \ 0\ mol \ de \ CO_{(g)} \ e \ \ 0 \ mol\ de \ O_2_{(g)})
Reação: reagem de acordo com a estequiometria da reação:
} \ ; \ se\ formam \ 2x\ mol \ de \ CO_{(g)} \ e \ \ x \ mol\ de \ O_2_{(g)})
Equilíbrio restam:
} \ ; \ se\ formam \ 0,2\ mol \ de \ CO_{(g)} \ e \ \ 0,1 \ mol\ de \ O_2_{(g)})
Podemos encontrar x a partir da seguinte relação:
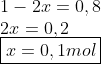
Pelo expressão abaixo temos que:
![\\Kc = \frac{[CO ]^2\cdot[O_2]}{[CO_2]^2}\\\\ Kc = \frac{(0,2)^2\cdot (0,1)}{0,8^2}\therefore 625\cdot10^{-5}](http://latex.codecogs.com/gif.latex?\\Kc = \frac{[CO ]^2\cdot[O_2]}{[CO_2]^2}\\\\ Kc = \frac{(0,2)^2\cdot (0,1)}{0,8^2}\therefore 625\cdot10^{-5})
c) A elevação da temperatura aumenta a velocidade da reação no sentido 1, ou seja, sentido endotérmico.
d) Como o sentido 1 é endotérmico, ao aumentarmos a temperatura o equilíbrio é deslocado para direita, isto significa que a substância (denominador) está sendo consumida e que as outras substâncias CO e O2 (numerador) estão sendo formadas. Assim, com a diminuição do denominador e aumento do numerador o valor de uma fração aumenta, isto matematicamente falando.
Quimicamente falando: isto que dizer que estamos consumindo CO2 e formando CO e O2 , ou seja, o equilíbrio esta sendo deslocado no sentido direto!
Sabemos que:
![kc=\frac{[CO]^2\cdot[O_2]}{[CO_2]^2}](http://latex.codecogs.com/gif.latex?kc=\frac{[CO]^2\cdot[O_2]}{[CO_2]^2})
Como as concentrações de CO e O2 aumentam e simultaneamente a concentração de CO2 diminui temos que kc aumenta ao aumentarmos a temperatura!
e) Como determinamos o valor de x podemos encontrar o quanto de CO2(g) reagiu:
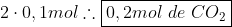
O rendimento da reação direta, no caso será dado por:
}{(quantidade\ inicial\ de\ mols)})
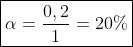
Percebemos o CO2(g) não é totalmente consumido o que é bastante óbvio, pois não teríamos uma situação de equilíbrio químico.
Resposta: Letra E
Espero ter ajudado!
Primeiramente vamos calcular a molaridade incial do anidrido carbônico presente no recipiente
Início da reação há:
Reação: reagem de acordo com a estequiometria da reação:
Equilíbrio restam:
Podemos encontrar x a partir da seguinte relação:
Pelo expressão abaixo temos que:
c) A elevação da temperatura aumenta a velocidade da reação no sentido 1, ou seja, sentido endotérmico.
d) Como o sentido 1 é endotérmico, ao aumentarmos a temperatura o equilíbrio é deslocado para direita, isto significa que a substância (denominador) está sendo consumida e que as outras substâncias CO e O2 (numerador) estão sendo formadas. Assim, com a diminuição do denominador e aumento do numerador o valor de uma fração aumenta, isto matematicamente falando.
Quimicamente falando: isto que dizer que estamos consumindo CO2 e formando CO e O2 , ou seja, o equilíbrio esta sendo deslocado no sentido direto!
Sabemos que:
Como as concentrações de CO e O2 aumentam e simultaneamente a concentração de CO2 diminui temos que kc aumenta ao aumentarmos a temperatura!
e) Como determinamos o valor de x podemos encontrar o quanto de CO2(g) reagiu:
O rendimento da reação direta, no caso será dado por:
Percebemos o CO2(g) não é totalmente consumido o que é bastante óbvio, pois não teríamos uma situação de equilíbrio químico.
Resposta: Letra E
Espero ter ajudado!

Diegomedbh- Jedi

- Mensagens : 477
Data de inscrição : 11/03/2012
Idade : 34
Localização : Belo Horizonte, MG Brasil
 Tópicos semelhantes
Tópicos semelhantes» Equilíbrio químico - grau de equilíbrio
» Equilíbrio Químico
» Equilíbrio Químico
» Equilibrio quimico
» Equilibrio Quimico
» Equilíbrio Químico
» Equilíbrio Químico
» Equilibrio quimico
» Equilibrio Quimico
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












