ITA 66 - Eletroquímica
3 participantes
Página 1 de 1
 ITA 66 - Eletroquímica
ITA 66 - Eletroquímica
Eletrolisando uma solução aquosa de NaCl durante 20 minutos, com corrente constante de 10 Ampères,obtém-se gás cloro no ânodo, que foi integralmente convertido em gás clorídrico. Este, dissolvido em água, forma 100 mL de ácido clorídrico que foi exatamente neutralizado por 50 mL de uma solução aquosa de um hidróxido. Pede-se:
a)Qual o volume em mL de cloro formado, medido nas CNTP?
b)Qual a normalidade do hidróxido?
a)Qual o volume em mL de cloro formado, medido nas CNTP?
b)Qual a normalidade do hidróxido?
João Mafra- Iniciante
- Mensagens : 14
Data de inscrição : 06/02/2013
Idade : 31
Localização : Brasília Distrito Federal
 Re: ITA 66 - Eletroquímica
Re: ITA 66 - Eletroquímica
Tem gabarito?
joaoxky- Recebeu o sabre de luz

- Mensagens : 118
Data de inscrição : 26/04/2012
Idade : 30
Localização : Goiás; Brasil
 Re: ITA 66 - Eletroquímica
Re: ITA 66 - Eletroquímica
Não tenho, infelizmente.
João Mafra- Iniciante
- Mensagens : 14
Data de inscrição : 06/02/2013
Idade : 31
Localização : Brasília Distrito Federal
 Re: ITA 66 - Eletroquímica
Re: ITA 66 - Eletroquímica
Aqui vai minha tentativa:
a)Pela reação de eletrólise do cloro:
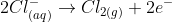
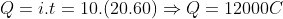
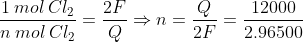
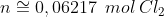
Nas CNTP: P = 1 atm; T = 273K
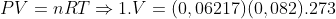
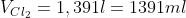
b)
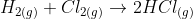
Pela proporção estequiométrica da reação:
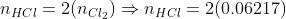
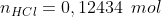
0,12434 mol de HCl(g) serão dissolvidos em 100mL de água, formando HCl(aq)
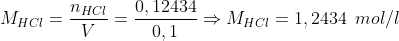
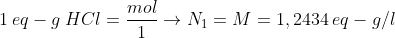
Pela equação fundamental da volumetria:
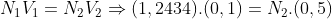
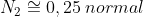
a)Pela reação de eletrólise do cloro:
Nas CNTP: P = 1 atm; T = 273K
b)
Pela proporção estequiométrica da reação:
0,12434 mol de HCl(g) serão dissolvidos em 100mL de água, formando HCl(aq)
Pela equação fundamental da volumetria:

Rock6446- Jedi

- Mensagens : 242
Data de inscrição : 26/05/2012
Idade : 30
Localização : Brasília, DF, Brasil
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












