estequiometria
2 participantes
Página 1 de 1
 estequiometria
estequiometria
Acerte os coeficientes da equação:
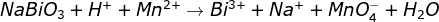
gabarito: os coeficientes da esquerda para direita são:5,14,2,5,5,2,7
gabarito: os coeficientes da esquerda para direita são:5,14,2,5,5,2,7
Leandro!- Mestre Jedi

- Mensagens : 963
Data de inscrição : 12/07/2011
Idade : 32
Localização : Rio de Janeiro - RJ
 Re: estequiometria
Re: estequiometria
Olá, Leandro,
nesse tipo de questão vc tem que unir duas formas de análises estequiométricas: o método redox e o método algébrico.
Perceba:
Reagentes:
Bi ---> NOX=+5
Mn ---> NOX=+2
Produtos:
Bi --->NOX=+3
Mn ---> NOX=+7
Logo, o bismuto reduz 2 elétrons e o manganês oxida 5 elétrons. Porém, a quantidade de elétrons que sai deve ser igual a quantidade de elétrons que chegam.
Logo, o coeficiente do NaBiO3 e do Bi+3 será 5 e o coeficente estequiométrico do Mn+2 e do MnO4- será 2.
Método algébrico:
Atribua incógnitas aos compostos:
ANaBiO3+BH++CMn+2 -->DBi+3+ENa++FMnO4-+GH2O
A=E
A=D
3A=4F+G
B=2G
C=F
------------------------------------------------------------
Resolvendo as equações, tem-se que:
A=5
E=5
D=5
C=2
F=2
G=7
B=14
Logo, a equação será:
5NaBiO3+14H++2Mn+2 -->5Bi+3+5Na++2MnO4-+7H2O

nesse tipo de questão vc tem que unir duas formas de análises estequiométricas: o método redox e o método algébrico.
Perceba:
Reagentes:
Bi ---> NOX=+5
Mn ---> NOX=+2
Produtos:
Bi --->NOX=+3
Mn ---> NOX=+7
Logo, o bismuto reduz 2 elétrons e o manganês oxida 5 elétrons. Porém, a quantidade de elétrons que sai deve ser igual a quantidade de elétrons que chegam.
Logo, o coeficiente do NaBiO3 e do Bi+3 será 5 e o coeficente estequiométrico do Mn+2 e do MnO4- será 2.
Método algébrico:
Atribua incógnitas aos compostos:
ANaBiO3+BH++CMn+2 -->DBi+3+ENa++FMnO4-+GH2O
A=E
A=D
3A=4F+G
B=2G
C=F
------------------------------------------------------------
Resolvendo as equações, tem-se que:
A=5
E=5
D=5
C=2
F=2
G=7
B=14
Logo, a equação será:
5NaBiO3+14H++2Mn+2 -->5Bi+3+5Na++2MnO4-+7H2O
![[Planck]³](https://2img.net/u/2713/85/25/58/avatars/19563-97.jpg)
[Planck]³- Fera

- Mensagens : 673
Data de inscrição : 11/02/2012
Idade : 31
Localização : Mossoró-RN
 Re: estequiometria
Re: estequiometria
Planck, existiria alguma forma de fazer esse cálculo sem o método redox?Ou quando existirem equações com íons, só mesmo por redox?
Leandro!- Mestre Jedi

- Mensagens : 963
Data de inscrição : 12/07/2011
Idade : 32
Localização : Rio de Janeiro - RJ
 Re: estequiometria
Re: estequiometria
Leandro! escreveu:Planck, existiria alguma forma de fazer esse cálculo sem o método redox?Ou quando existirem equações com íons, só mesmo por redox?
Daria para fazer pelo método redox e depois por tentativa. Porém, essa forma que mostrei a você é a mais fácil (eu acho, pelo menos). Só por redox não dá, pois nem todos os compostos oxidam ou reduzem.
![[Planck]³](https://2img.net/u/2713/85/25/58/avatars/19563-97.jpg)
[Planck]³- Fera

- Mensagens : 673
Data de inscrição : 11/02/2012
Idade : 31
Localização : Mossoró-RN
 Re: estequiometria
Re: estequiometria
Obrigado, planck
Leandro!- Mestre Jedi

- Mensagens : 963
Data de inscrição : 12/07/2011
Idade : 32
Localização : Rio de Janeiro - RJ
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













