ESTEQUIOMETRIA
3 participantes
Página 1 de 1
 ESTEQUIOMETRIA
ESTEQUIOMETRIA
UNICAMP
Com a intenção de proteger o motorista e o passageiro de lesões corporais mais graves, em muitos países já é obrigatório, em automóveis, o dispositivo chamado de “air bag” . Em caso de acidente um microprocessador desencadeia uma série de reações químicas que liberam uma certa quantidade de nitrogênio,) , que infla rapidamente um balão plástico situado à frente dos ocupantes do automóvel. As reações químicas que ocorrem nesse processo estão representadas pelas seguintes equações:
, que infla rapidamente um balão plástico situado à frente dos ocupantes do automóvel. As reações químicas que ocorrem nesse processo estão representadas pelas seguintes equações:

No caso de acionamento do sistema de segurança descrito, supondo que o volume do saco plástico, quando totalmente inflado, seja de 70 litros e que, inicialmente, houvesse 2,0 moles de e 2,0 moles de
e 2,0 moles de 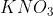 :
:
a) Qual será a pressão do gás (em kPa), dentro do balão, quando este estiver totalmente inflado? Considere a temperatura como sendo 27°C.

b) Supondo-se que o processo envolvesse apenas as reações representadas pelas equações 1 e 2, qual seria a massa total de substâncias sólidas restantes no sistema?
Gabarito:
a)113,83 kPa
b) m=242,6 g
Com a intenção de proteger o motorista e o passageiro de lesões corporais mais graves, em muitos países já é obrigatório, em automóveis, o dispositivo chamado de “air bag” . Em caso de acidente um microprocessador desencadeia uma série de reações químicas que liberam uma certa quantidade de nitrogênio,

No caso de acionamento do sistema de segurança descrito, supondo que o volume do saco plástico, quando totalmente inflado, seja de 70 litros e que, inicialmente, houvesse 2,0 moles de
a) Qual será a pressão do gás (em kPa), dentro do balão, quando este estiver totalmente inflado? Considere a temperatura como sendo 27°C.

b) Supondo-se que o processo envolvesse apenas as reações representadas pelas equações 1 e 2, qual seria a massa total de substâncias sólidas restantes no sistema?
Gabarito:
a)113,83 kPa
b) m=242,6 g
Última edição por balanar em Ter 26 Abr 2011, 11:53, editado 1 vez(es)

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
Oi Balanar,
são 2 moles de NaNO3 ou de NaN3?
Pergunto isso porque não tem NaNO3 em nenhuma equação.
são 2 moles de NaNO3 ou de NaN3?
Pergunto isso porque não tem NaNO3 em nenhuma equação.
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
Você tem razão Luís, eu digitei errado...
Concertei já
Concertei já

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
Vamos lá,
A) Nós temos que transformar essas três equações em apenas uma. Pra isso temos que ir cancelando compostos que são iguais nos reagentes de uma equação e nos produtos de outra.
Começando pelas duas primeiras (já multipliquei a 1ª por 5 pra cancelar os Na):
10 NaN3 ===> 10 Na + 15 N2
10 Na + 2 KNO3 ===> 5 Na2O + K2O + N2
Cancelando os Na e somando as 2 equações:
10 NaN3 + 2 KNO3 ===> 5 Na2O + K2O + 16 N2
Acrescentando a 3ª equação:
10 NaN3 + 2 KNO3 ===> 5 Na2O + K2O + 16 N2
K2O + Na2O + SiO2 ===> vidro
Cancelando os K2O e multiplicando a seguir esse última equação por 5 para cancelar os Na2O:
10 NaN3 + 2 KNO3 ===> 5 Na2O + 16 N2
5 Na2O + 5 SiO2 ===> 5 vidro
Cancelando os Na2O e somando as equações:
10 NaN3 + 2 KNO3 + 5 SiO2 ===> 5 vidro + 16 N2
Usando a fórmula n = m / MM para 2 mols de NaN3:
2 = m / 65
m = 130 g de NaN3 que reagiram
Fazendo a relação com o N2:
10*65 g de NaN3 --------- 16*28 g de N2
130 g de NaN3 ------------ X
X = 89,6 g de N2
n = 89,6 / 28
n = 3,2 mols de N2
Usando a equação de Clapeyron: p*V = n*R*T (temperatura em kelvin):
p*70 = 3,2*8,3*300
===> p = 113,83 kPa <===
Dava pra fazer com KNO3 também. Como a estequiometria é de 10 mols de NaN3 para 2 mols de KNO3, deve haver excesso de KNO3:
10 mols de NaN3 ----- 2 mols de KNO3
2 mols de NaN3 ------ X
X = 0,4 mol de KNO3
0,4 = m / 101
m = 40,4 g de KNO3
Fazendo a relação com o N2:
2*101 g de KNO3 -------- 16*28 g de N2
40,4 g de KNO3 ---------- X
X = 89,6 g de N2 (a mesma massa e consequentemente o mesmo número de mol)
B) A minha resposta deu um pouco diferente do gabarito. Não sei se foi algum arredondamento que eu fiz ou se errei em alguma parte.
Vamos pegar a equação simplificada das duas primeiras:
10 NaN3 + 2 KNO3 ===> 5 Na2O + K2O + 16 N2
10*65 g de NaN3 ---------- 5*62 g de Na2O
130 g de NaN3 ------------ Y
Y = 62 g de Na2O
10*65 g de NaN3 ----------- 1*94 g de K2O
130 g de NaN3 ------------- Z
Z = 18,8 g de K2O
Somando as massas dos compostos sólidos (todos com exceção de N2):
130 g de NaN3 + 40,4 g de KNO3 + 62 g de Na2O + 18,8 g de K2O = 251,2 g
Abraço!
A) Nós temos que transformar essas três equações em apenas uma. Pra isso temos que ir cancelando compostos que são iguais nos reagentes de uma equação e nos produtos de outra.
Começando pelas duas primeiras (já multipliquei a 1ª por 5 pra cancelar os Na):
10 NaN3 ===> 10 Na + 15 N2
10 Na + 2 KNO3 ===> 5 Na2O + K2O + N2
Cancelando os Na e somando as 2 equações:
10 NaN3 + 2 KNO3 ===> 5 Na2O + K2O + 16 N2
Acrescentando a 3ª equação:
10 NaN3 + 2 KNO3 ===> 5 Na2O + K2O + 16 N2
K2O + Na2O + SiO2 ===> vidro
Cancelando os K2O e multiplicando a seguir esse última equação por 5 para cancelar os Na2O:
10 NaN3 + 2 KNO3 ===> 5 Na2O + 16 N2
5 Na2O + 5 SiO2 ===> 5 vidro
Cancelando os Na2O e somando as equações:
10 NaN3 + 2 KNO3 + 5 SiO2 ===> 5 vidro + 16 N2
Usando a fórmula n = m / MM para 2 mols de NaN3:
2 = m / 65
m = 130 g de NaN3 que reagiram
Fazendo a relação com o N2:
10*65 g de NaN3 --------- 16*28 g de N2
130 g de NaN3 ------------ X
X = 89,6 g de N2
n = 89,6 / 28
n = 3,2 mols de N2
Usando a equação de Clapeyron: p*V = n*R*T (temperatura em kelvin):
p*70 = 3,2*8,3*300
===> p = 113,83 kPa <===
Dava pra fazer com KNO3 também. Como a estequiometria é de 10 mols de NaN3 para 2 mols de KNO3, deve haver excesso de KNO3:
10 mols de NaN3 ----- 2 mols de KNO3
2 mols de NaN3 ------ X
X = 0,4 mol de KNO3
0,4 = m / 101
m = 40,4 g de KNO3
Fazendo a relação com o N2:
2*101 g de KNO3 -------- 16*28 g de N2
40,4 g de KNO3 ---------- X
X = 89,6 g de N2 (a mesma massa e consequentemente o mesmo número de mol)
B) A minha resposta deu um pouco diferente do gabarito. Não sei se foi algum arredondamento que eu fiz ou se errei em alguma parte.
Vamos pegar a equação simplificada das duas primeiras:
10 NaN3 + 2 KNO3 ===> 5 Na2O + K2O + 16 N2
10*65 g de NaN3 ---------- 5*62 g de Na2O
130 g de NaN3 ------------ Y
Y = 62 g de Na2O
10*65 g de NaN3 ----------- 1*94 g de K2O
130 g de NaN3 ------------- Z
Z = 18,8 g de K2O
Somando as massas dos compostos sólidos (todos com exceção de N2):
130 g de NaN3 + 40,4 g de KNO3 + 62 g de Na2O + 18,8 g de K2O = 251,2 g
Abraço!
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
Oi Luís,eu entendi assim.........
2NaN3--->2Na+3N2 -------Eq 1
10Na+2KNO3--->5Na2O+K20+N2 -------Eq 2
K2O+Na2O+SiO2--->vidro -------Eq 3
Multiplicando a Eq 1 por 5 e somando com a Eq2 e simplificando vem:
10NaN3+2KNO3--->5Na2O+K2O+16N2 ------Eq 4
Temos 2 moles de NaN3 e 2 moles de KNO3
Então da Eq 4 vem:
n(NaN3)/10 = n(N2)/16 --->Para NaN3=2
n(NaN3)=3,2 mol de N2
Fazendo para o KNO3, vem:
n(KNO3)/2 = n(N2)/16 --->Para KNO3=2
n(KNO3)=16 mol de N2
Como o NaN3 possui menor quantidade de moles de N2 ele é o reagente limitante.
Usando a equação de Clapeyron: p*V = n*R*T (temperatura em kelvin):
p*70 = 3,2*8,3*300
===> p = 113,83 kPa <===
b)
Partindo da equação 4 vem:
10NaN3+2KNO3--->5Na2O+K2O+16N2 ------Eq 4
O NaN3 por ser o reagente limitante foi totalmente consumido na reação restando assim a massa do KNO3 e do produto formado que são:
Na2O e K2O. (N2 é gas).
Então vamos relacionar os 3,2 moles de N2 (o que efetivamente reagiu do N2 com as demais quantidades), logo:
n(KNO3)/2 = n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(KNO3)=0,4 moles de KNO3 -->Ou seja dos 2 moles iniciais de KNO3 apenas 0,4 reagiram, ou seja (2-,0,4)=1,6 moles não reagiram
n(KNO3)=1,6 moles não reagiram
Agora para o Na2O vem:
n(Na2O)/5 = n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(Na2O)=1 mol
Finalmente para o K2O vem:
n( K2O)/1= n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(K2O)=0,2 mol
Juntando temos:
n(KNO3)=1,6 mol
n(Na2O)=1 mol
n(K2O)=0,2 mol
Lembrando que n=m/MM vem:
m=(1,6.101,1+62.1+0,2.94,2)=242,6 g
Esse exercício estava resolvido no livro porém eu não tinha entendido a resolução dele, agora ficou claro.
É isso a letra "b" né Luís?
2NaN3--->2Na+3N2 -------Eq 1
10Na+2KNO3--->5Na2O+K20+N2 -------Eq 2
K2O+Na2O+SiO2--->vidro -------Eq 3
Multiplicando a Eq 1 por 5 e somando com a Eq2 e simplificando vem:
10NaN3+2KNO3--->5Na2O+K2O+16N2 ------Eq 4
Temos 2 moles de NaN3 e 2 moles de KNO3
Então da Eq 4 vem:
n(NaN3)/10 = n(N2)/16 --->Para NaN3=2
n(NaN3)=3,2 mol de N2
Fazendo para o KNO3, vem:
n(KNO3)/2 = n(N2)/16 --->Para KNO3=2
n(KNO3)=16 mol de N2
Como o NaN3 possui menor quantidade de moles de N2 ele é o reagente limitante.
Usando a equação de Clapeyron: p*V = n*R*T (temperatura em kelvin):
p*70 = 3,2*8,3*300
===> p = 113,83 kPa <===
b)
Partindo da equação 4 vem:
10NaN3+2KNO3--->5Na2O+K2O+16N2 ------Eq 4
O NaN3 por ser o reagente limitante foi totalmente consumido na reação restando assim a massa do KNO3 e do produto formado que são:
Na2O e K2O. (N2 é gas).
Então vamos relacionar os 3,2 moles de N2 (o que efetivamente reagiu do N2 com as demais quantidades), logo:
n(KNO3)/2 = n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(KNO3)=0,4 moles de KNO3 -->Ou seja dos 2 moles iniciais de KNO3 apenas 0,4 reagiram, ou seja (2-,0,4)=1,6 moles não reagiram
n(KNO3)=1,6 moles não reagiram
Agora para o Na2O vem:
n(Na2O)/5 = n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(Na2O)=1 mol
Finalmente para o K2O vem:
n( K2O)/1= n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(K2O)=0,2 mol
Juntando temos:
n(KNO3)=1,6 mol
n(Na2O)=1 mol
n(K2O)=0,2 mol
Lembrando que n=m/MM vem:
m=(1,6.101,1+62.1+0,2.94,2)=242,6 g
Esse exercício estava resolvido no livro porém eu não tinha entendido a resolução dele, agora ficou claro.
É isso a letra "b" né Luís?

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
balanar escreveu:Oi Luís,eu entendi assim.........
2NaN3--->2Na+3N2 -------Eq 1
10Na+2KNO3--->5Na2O+K20+N2 -------Eq 2
K2O+Na2O+SiO2--->vidro -------Eq 3
Multiplicando a Eq 1 por 5 e somando com a Eq2 e simplificando vem:
10NaN3+2KNO3--->5Na2O+K2O+16N2 ------Eq 4
Temos 2 moles de NaN3 e 2 moles de KNO3
Então da Eq 4 vem:
n(NaN3)/10 = n(N2)/16 --->Para NaN3=2
n(NaN3)=3,2 mol de N2
Fazendo para o KNO3, vem:
n(KNO3)/2 = n(N2)/16 --->Para KNO3=2
n(KNO3)=16 mol de N2
Como o NaN3 possui menor quantidade de moles de N2 ele é o reagente limitante.
Usando a equação de Clapeyron: p*V = n*R*T (temperatura em kelvin):
p*70 = 3,2*8,3*300
===> p = 113,83 kPa <===
b)
Partindo da equação 4 vem:
10NaN3+2KNO3--->5Na2O+K2O+16N2 ------Eq 4
O NaN3 por ser o reagente limitante foi totalmente consumido na reação restando assim a massa do KNO3 e do produto formado que são:
Na2O e K2O. (N2 é gas).
Então vamos relacionar os 3,2 moles de N2 (o que efetivamente reagiu do N2 com as demais quantidades), logo:
n(KNO3)/2 = n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(KNO3)=0,4 moles de KNO3 -->Ou seja dos 2 moles iniciais de KNO3 apenas 0,4 reagiram, ou seja (2-,0,4)=1,6 moles não reagiram
n(KNO3)=1,6 moles não reagiram
Agora para o Na2O vem:
n(Na2O)/5 = n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(Na2O)=1 mol
Finalmente para o K2O vem:
n( K2O)/1= n(N2)/16 ---> Para N2=3,2 moles (o que efetivamente reagiu)
n(K2O)=0,2 mol
Juntando temos:
n(KNO3)=1,6 mol
n(Na2O)=1 mol
n(K2O)=0,2 mol
Lembrando que n=m/MM vem:
m=(1,6.101,1+62.1+0,2.94,2)=242,6 g
Esse exercício estava resolvido no livro porém eu não tinha entendido a resolução dele, agora ficou claro.
É isso a letra "b" né Luís?
Corrigindo a parte em vermelho....
O NaN3 gera 3,2 moles de N2
Enquanto que....
O KNO3 gera 16 moles então o NaN3 é o reagente limitante.

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
Perfeito Balanar!
Ele pede a massa total de substâncias sólidas restantes no sistema.
Como o NaN3 reagiu completamente, não sobra nada dele. Para o KNO3 tem que diminuir pois ele é o reagente em excesso. Quanto ao Na2O e K2O nenhum problema.
Eu vi que eu tinha errado em alguma coisa. Não podia dar uma diferença de quase 10 g só por arredondamento.
Abraço! Desculpe pelo engano!
Ele pede a massa total de substâncias sólidas restantes no sistema.
Como o NaN3 reagiu completamente, não sobra nada dele. Para o KNO3 tem que diminuir pois ele é o reagente em excesso. Quanto ao Na2O e K2O nenhum problema.
Eu vi que eu tinha errado em alguma coisa. Não podia dar uma diferença de quase 10 g só por arredondamento.
Abraço! Desculpe pelo engano!
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
Vlw pela ajuda Luís


Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
Adam Zunoeta escreveu:Temos 2 moles de NaN3 e 2 moles de KNO3
Então da Eq 4 vem:
n(NaN3)/10 = n(N2)/16 --->Para NaN3=2
n(NaN3)=3,2 mol de N2
Adam, por favor você poderia me explicar essa parte?

Nat'- Mestre Jedi

- Mensagens : 795
Data de inscrição : 13/06/2012
Idade : 30
Localização : São José dos Campos - SP , Brasil
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












