FUVEST Soluções
2 participantes
Página 1 de 1
 FUVEST Soluções
FUVEST Soluções
Soluções aquosas de ácido clorídrico, HCl (aq), e de ácido acético, H3CCOOH (aq), ambas de concentração 0,10 mol/L, apresentam valores de pH iguais a 1,0 e 2,9, respectivamente.
Em experimentos separados, volumes iguais de cada uma dessas soluções foram titulados com uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração adequada. Nessas titulações, a solução de NaOH foi adicionada lentamente ao recipiente contendo a solução ácida, até reação completa. Sejam V1 o volume da solução de NaOH para reação completa com a solução de HCl e V2 o volume da solução de NaOH para reação completa com a solução de H3CCOOH. A relação entre V1 e V2 é:
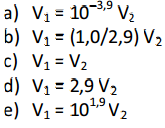
A alternativa correta é C. Na resolução que li, como as concentrações são as mesmas e a neutralização é total, então o V de NaOH é o mesmo. Mas porque a quantidade de pH, especificamente a concentração de H+ do ácido acético, não influência nesse resultado?
Obrigada
Em experimentos separados, volumes iguais de cada uma dessas soluções foram titulados com uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração adequada. Nessas titulações, a solução de NaOH foi adicionada lentamente ao recipiente contendo a solução ácida, até reação completa. Sejam V1 o volume da solução de NaOH para reação completa com a solução de HCl e V2 o volume da solução de NaOH para reação completa com a solução de H3CCOOH. A relação entre V1 e V2 é:
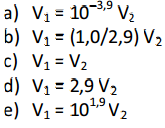
A alternativa correta é C. Na resolução que li, como as concentrações são as mesmas e a neutralização é total, então o V de NaOH é o mesmo. Mas porque a quantidade de pH, especificamente a concentração de H+ do ácido acético, não influência nesse resultado?
Obrigada

Sunriseee- Jedi

- Mensagens : 268
Data de inscrição : 20/05/2016
Idade : 28
Localização : SP - Brasil
 Re: FUVEST Soluções
Re: FUVEST Soluções
Pois para ocorrer neutralização total, basta que o ácido e a base reajam na proporção estequiométrica (e isso independe do pH do ácido).
HCl + NaOH --> NaCl + H20
Há 0,1*V mol de HCl .: Deve haver 0,1*V mol de NaOH
H3CCOOH + NaOH --> Na(H3CCOO) + H2O
Há 0,1*V mol de ác. acético .: Tbm deve haver 0,1*V mol de NaOH
Ora, se tanto o número de mols quanto as concentrações são iguais, então conclui-se que os volumes também são iguais.
HCl + NaOH --> NaCl + H20
Há 0,1*V mol de HCl .: Deve haver 0,1*V mol de NaOH
H3CCOOH + NaOH --> Na(H3CCOO) + H2O
Há 0,1*V mol de ác. acético .: Tbm deve haver 0,1*V mol de NaOH
Ora, se tanto o número de mols quanto as concentrações são iguais, então conclui-se que os volumes também são iguais.
____________________________________________
Cha-la head-cha-la

Vitor Ahcor- Monitor

- Mensagens : 780
Data de inscrição : 21/12/2018
Idade : 24
Localização : Taurdal
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












