Termoquímica- Reação de dissolução
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Termoquímica- Reação de dissolução
Termoquímica- Reação de dissolução
A dissolução de um sal em água pode ocorrer com liberação de calor, absorção de calor ou sem efeito térmico. Conhecidos os calores envolvidos nas transformações, mostradas no diagrama que se segue, é possível calcular o calor da dissolução de cloreto de sódio sólido em água, produzindo Na+(aq) e Cl–(aq).
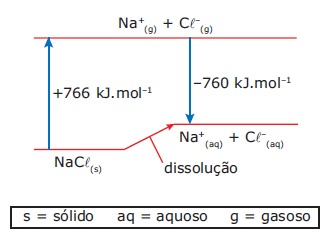
Com os dados fornecidos, pode-se afirmar que a dissolução de 1 mol desse sal
A) é acentuadamente exotérmica, envolvendo cerca de 103 kJ.
B) é pouco endotérmica, envolvendo menos de 10 kJ.
C) ocorre sem troca de calor.
D) é pouco exotérmica, envolvendo menos de 10 kJ.
E) é acentuadamente endotérmica, envolvendo cerca de 103 kJ.
Por que é a b) e não a d), sendo que, para a soma dos vetores ser nula, tem que ser igual a -6 (exotérmico)??

Com os dados fornecidos, pode-se afirmar que a dissolução de 1 mol desse sal
A) é acentuadamente exotérmica, envolvendo cerca de 103 kJ.
B) é pouco endotérmica, envolvendo menos de 10 kJ.
C) ocorre sem troca de calor.
D) é pouco exotérmica, envolvendo menos de 10 kJ.
E) é acentuadamente endotérmica, envolvendo cerca de 103 kJ.
Por que é a b) e não a d), sendo que, para a soma dos vetores ser nula, tem que ser igual a -6 (exotérmico)??
Liliana Rodrigues- Estrela Dourada

- Mensagens : 2082
Data de inscrição : 16/03/2016
Idade : 27
Localização : Ribeirão Preto - SP
 Re: Termoquímica- Reação de dissolução
Re: Termoquímica- Reação de dissolução
766+(-760)=6kJ.mol^-1
Endotérmica.
Não sou adivinha: o que é esse -6 que você diz? Ele deve ser igual a que?
Os carros andam normalmente a 100, 100 m/s, ou a 100 km/h?
Endotérmica.
Não sou adivinha: o que é esse -6 que você diz? Ele deve ser igual a que?
Os carros andam normalmente a 100, 100 m/s, ou a 100 km/h?
Convidado- Convidado
 Tópicos semelhantes
Tópicos semelhantes» Toda dissolução é uma reação?
» (UnB-DF / Adaptado) A reação de dissolução do
» DUVIDA REAÇÃO - TERMOQUIMICA
» DISSOLUÇÃO
» Termoquímica calor da reação de esterificação
» (UnB-DF / Adaptado) A reação de dissolução do
» DUVIDA REAÇÃO - TERMOQUIMICA
» DISSOLUÇÃO
» Termoquímica calor da reação de esterificação
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













