ESTEQUIOMETRIA
2 participantes
Página 1 de 1
 ESTEQUIOMETRIA
ESTEQUIOMETRIA
O sulfato de cobre II é um sal com ampla aplicação na agricultura (fungicida, fertilizante, componente da
ração de animais, etc.). Ele é obtido industrialmente através de um processo que, de forma simplificada, pode
ser representado pela seguinte equação:
CuO(s) + H2SO4(aq) --> CuSO4(aq) + H2O( )
Em relação ao sistema contendo 10,0 mol de CuO e 1,30 kg de H2SO4, pode-se afirmar que :
a) A adição de maior quantidade de H2SO4 ao sistema aumenta a massa de CuSO4 formada.
b) A quantidade de CuSO4 formada será inferior a 13 mol.
c) A quantidade de CuSO4 (em mol), no final da reação, será igual à quantidade de H2SO4 (em mol) no início
da reação.
d) A solução resultante será neutra após a reação ter-se completado (não levar em conta o caráter do sal
obtido)
Dados os valores de massas atômicas da tabela periódica
ração de animais, etc.). Ele é obtido industrialmente através de um processo que, de forma simplificada, pode
ser representado pela seguinte equação:
CuO(s) + H2SO4(aq) --> CuSO4(aq) + H2O( )
Em relação ao sistema contendo 10,0 mol de CuO e 1,30 kg de H2SO4, pode-se afirmar que :
a) A adição de maior quantidade de H2SO4 ao sistema aumenta a massa de CuSO4 formada.
b) A quantidade de CuSO4 formada será inferior a 13 mol.
c) A quantidade de CuSO4 (em mol), no final da reação, será igual à quantidade de H2SO4 (em mol) no início
da reação.
d) A solução resultante será neutra após a reação ter-se completado (não levar em conta o caráter do sal
obtido)
Dados os valores de massas atômicas da tabela periódica
lucaslvj- Iniciante
- Mensagens : 35
Data de inscrição : 03/04/2016
Idade : 24
Localização : São Paulo,SP BRASIL
 Re: ESTEQUIOMETRIA
Re: ESTEQUIOMETRIA
CuO(s) + H2SO4(aq) --> CuSO4(aq) + H2O(aq)
MM(H2SO4) = 98g/mol
n(H2SO4) = 1300g/98g/mol = 13.26mols
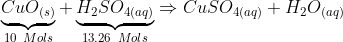
a) Falso, pois o CuO é agente limitante
b) Verdade, sera formado 10 mols de CuSO4
c) Falso, no inicio temos 13.26 mols de H2SO4, e no final teremos teremos 10 mols de CuSO4
d) Será acida, pois H2SO4 é um ácido forte
MM(H2SO4) = 98g/mol
n(H2SO4) = 1300g/98g/mol = 13.26mols
a) Falso, pois o CuO é agente limitante
b) Verdade, sera formado 10 mols de CuSO4
c) Falso, no inicio temos 13.26 mols de H2SO4, e no final teremos teremos 10 mols de CuSO4
d) Será acida, pois H2SO4 é um ácido forte

CaiqueF- Monitor

- Mensagens : 1237
Data de inscrição : 16/05/2012
Idade : 28
Localização : Salvador -> São Carlos
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












