Propriedades periódicas
2 participantes
Página 1 de 1
 Propriedades periódicas
Propriedades periódicas
(Unirio) O diagrama a seguir representa átomos de elementos com elétrons distribuídos em quatro níveis energéticos e que se
situam nos blocos s, p e d da Classificação Periódica.
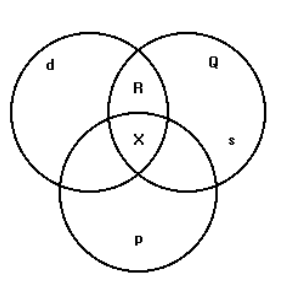
Considerando que s, p e d são conjuntos de átomos que apresentam, respectivamente, orbitais s no último nível, orbitais p no último nível e orbitais d no penúltimo nível e que formam os subconjuntos R, X e Q, só não podemos afirmar
corretamente que:
a) um átomo situado em Q pertence ao subgrupo A, do grupo 1 ou 2 da Classificatória Periódica.
b) um átomo situado em Q tem número atômico 19 e 20.
c) os átomos situados em X têm números atômicos que variam de 19 a 36.
d) os átomos situados em R têm números atômicos que variam de 21 a 30.
e) os átomos situados em R são elementos classificados como metais.
situam nos blocos s, p e d da Classificação Periódica.
Considerando que s, p e d são conjuntos de átomos que apresentam, respectivamente, orbitais s no último nível, orbitais p no último nível e orbitais d no penúltimo nível e que formam os subconjuntos R, X e Q, só não podemos afirmar
corretamente que:
a) um átomo situado em Q pertence ao subgrupo A, do grupo 1 ou 2 da Classificatória Periódica.
b) um átomo situado em Q tem número atômico 19 e 20.
c) os átomos situados em X têm números atômicos que variam de 19 a 36.
d) os átomos situados em R têm números atômicos que variam de 21 a 30.
e) os átomos situados em R são elementos classificados como metais.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Propriedades periódicas
Re: Propriedades periódicas
Alternativa por alternativa:
a) Q = orbitais s no último nível. Possui, portanto, 1 elétron ou dois na última camada. É, portanto, da família 1A/2A. Verdadeiro.
b) Novamente, Q. Pertence à 1A/2A. Faça a distribuição e veja que 19 e 20 pertencem a esses grupos. Verdadeiro.
c) X = orbitais s no último nível, p no último nível e d no penúltimo nível. O elemento de Z = 19 não possui orbital d em sua penúltima camada. Falso.
d) R = orbitais s no último nível e d no penúltimo nível. A partir do elemento de Z = 21, note que os elementos passam a ter elétrons no orbital d no penúltimo, indo continuamente desta forma até o 30. Verdadeiro.
e) Obviamente, os elementos que possuem subnível mais energético d são de transição externa, portanto, são metais. Verdadeiro.
Gabarito errado. A alternativa C com certeza absolutíssima está errada e a E com a mesma certeza está correta.
 Re: Propriedades periódicas
Re: Propriedades periódicas
Muito obrigado, mais uma vez. Você poderia me explicar rapidamente o que quer dizer transição interna e externa? Sempre vi esses termos mas nunca alguém explicou ao que se deve esses nomes.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Propriedades periódicas
Re: Propriedades periódicas
Elementos de transição interna são os lantanídeos e os actinídeos da tabela periódica (aqueles que costumam a ficar resumidos em um único "quadrado"). Recebem este nome pois possuem seus elétrons mais energéticos (o elétron mais energético de um átomo é o que possui a maior soma dos valores de "n" (energia de nível) e de l (energia de subnível)) no orbital f.
Elementos de transição externa são os metais da família 3B à 2B. Recebem este nome pois possuem seus elétrons mais energéticos no orbital d.
Elementos de transição externa são os metais da família 3B à 2B. Recebem este nome pois possuem seus elétrons mais energéticos no orbital d.
 Re: Propriedades periódicas
Re: Propriedades periódicas
Isso ok, mas por que transição? Qual é esta tal transição que ocorre com eles? Transição indica mudança, mas não sei qual é essa mudança...

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Propriedades periódicas
Re: Propriedades periódicas
"Jensen reviews the history of the terms "transition element" (or "metal") and "d-block". The word transition was first used to describe the elements now known as the d-block by the English chemist Charles Bury in 1921, who referred to a transition series of elements during the change of an inner layer of electrons (for example n=3 in the 4th row of the periodic table) from a stable group of 8 to one of 18, or from 18 to 32."
São chamados desta forma pois estão em transição entre um grupo estável de 8 elétrons e um grupo estável de 18, ou entre um grupo estável de 18 e um grupo estável de 32.
Pelo que eu pesquisei, os de subnível f recebem o nome de "transição interna" pois quando realizam ligações, os orbitais f são mais internos que os d que, portanto, são mais externos, e por isso recebem o nome de "transição externa".
O motivo pelo qual o nome é "transição" eu sei que é esse. Agora, a história do interno e externo não sei se tá certo. :scratch:
Se alguém mais bem entendido puder explicar, também vai me ajudar bastante.
São chamados desta forma pois estão em transição entre um grupo estável de 8 elétrons e um grupo estável de 18, ou entre um grupo estável de 18 e um grupo estável de 32.
Pelo que eu pesquisei, os de subnível f recebem o nome de "transição interna" pois quando realizam ligações, os orbitais f são mais internos que os d que, portanto, são mais externos, e por isso recebem o nome de "transição externa".
O motivo pelo qual o nome é "transição" eu sei que é esse. Agora, a história do interno e externo não sei se tá certo. :scratch:
Se alguém mais bem entendido puder explicar, também vai me ajudar bastante.
 Re: Propriedades periódicas
Re: Propriedades periódicas
Tranquilo, eu achei que era algo mais simples e que muita gente sabia xD Muito obrigado, Chries 

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Tópicos semelhantes
Tópicos semelhantes» Propriedades Periódicas
» Propriedades Periódicas
» propriedades periódicas
» Propriedades periódicas
» PROPRIEDADES PERIÓDICAS
» Propriedades Periódicas
» propriedades periódicas
» Propriedades periódicas
» PROPRIEDADES PERIÓDICAS
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













