pH e Hidrólise.
2 participantes
Página 1 de 1
 pH e Hidrólise.
pH e Hidrólise.
Quantos mililitros de uma solução 0,10 M de hidróxido de sódio são necessários para a reação completa com 0,61g de C6H5COOH (ácido benzoico sólido)? Qual é o pH da solução após a reação? Dados: C=12; O=16; H=1; Ka do ácido benzoico= 1*10^-4
agradeço.
obs: a resolução dessa questão tem no yahoo respostas, então se alguém quiser copiar a resolução de lá e me explicar eu agradeço. tem umas coisas que o cara fez lá que não entendi. hehe
Gabarito : 50 ml e pH = 8,5
agradeço.
obs: a resolução dessa questão tem no yahoo respostas, então se alguém quiser copiar a resolução de lá e me explicar eu agradeço. tem umas coisas que o cara fez lá que não entendi. hehe
Gabarito : 50 ml e pH = 8,5

spawnftw- Mestre Jedi

- Mensagens : 799
Data de inscrição : 14/05/2013
Idade : 28
Localização : Campinas, São Paulo
 Re: pH e Hidrólise.
Re: pH e Hidrólise.
Reação: 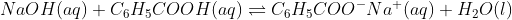
MM (C6H5COOH) = 122 g/mol
n (C6H5COOH) = 0,61g / (122 g/mol) = 0,005 mol
n (NaOH) = M.Vx = 0,1.Vx
Na reação de neutralização:
1 mol NaOH ---- 1 mol C6H5COOH
0,1.Vx ----------- 0,005 mol C6H5COOH
Vx = 0,050 L = 50 mL
----------------------------------------------------------------------
Obtém-se 0,005 mol de C6H5COO- (reação de neutralização na proporção de 1:1:1:1) que sofrerá hidrólise, conforme a reação:
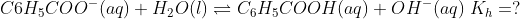
Calculando a constante de hidrólise:
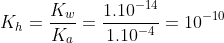
Cálculo de pH: ([C6H5COO-] = 0,005 mol / (0,050 L) = 0,1 mol/L
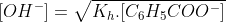 = 10^{-5,5}
= 10^{-5,5}
pOH = - log(10^{-5,5}) = 5,5
pH+pOH = 14 --> pH = 14-5,5 = 8,5
----------------------------------------
Espero que isso tenha ajudado.
MM (C6H5COOH) = 122 g/mol
n (C6H5COOH) = 0,61g / (122 g/mol) = 0,005 mol
n (NaOH) = M.Vx = 0,1.Vx
Na reação de neutralização:
1 mol NaOH ---- 1 mol C6H5COOH
0,1.Vx ----------- 0,005 mol C6H5COOH
Vx = 0,050 L = 50 mL
----------------------------------------------------------------------
Obtém-se 0,005 mol de C6H5COO- (reação de neutralização na proporção de 1:1:1:1) que sofrerá hidrólise, conforme a reação:
Calculando a constante de hidrólise:
Cálculo de pH: ([C6H5COO-] = 0,005 mol / (0,050 L) = 0,1 mol/L
pOH = - log(10^{-5,5}) = 5,5
pH+pOH = 14 --> pH = 14-5,5 = 8,5
----------------------------------------
Espero que isso tenha ajudado.

schow- Jedi

- Mensagens : 446
Data de inscrição : 03/01/2013
Idade : 29
Localização : Fortaleza-CE
 Re: pH e Hidrólise.
Re: pH e Hidrólise.
só não entendi o que foi feito no [OH-] = √Kh.[C6H5COO-]
mas de resto ta muito bom ^^
mas de resto ta muito bom ^^

spawnftw- Mestre Jedi

- Mensagens : 799
Data de inscrição : 14/05/2013
Idade : 28
Localização : Campinas, São Paulo
 Re: pH e Hidrólise.
Re: pH e Hidrólise.
Essa equação é muito usada nessas questões.
Segue a demontração: (considerando as variações de volume desprezíveis)
-------C6H5COO- + H2O <--> C6H5COOH + OH-
Início:.....M...............................0.................0
Variação:.-x..............................+x..............+x
Equilíbrio: (M-x)........................x.................x
Calculando a constante de equilíbrio, que apresenta ordem pequena:
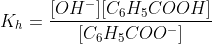
Sendo [OH-] = [C6H5COOH] = x e [C6H5COO-] = (M-x)
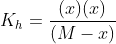
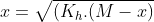
Sendo Kh de ondem muito pequena, infere-se que x< < < M, logo:
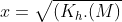 --> x = [OH-] e M = [C6H5COO-]
--> x = [OH-] e M = [C6H5COO-]
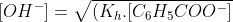

Segue a demontração: (considerando as variações de volume desprezíveis)
-------C6H5COO- + H2O <--> C6H5COOH + OH-
Início:.....M...............................0.................0
Variação:.-x..............................+x..............+x
Equilíbrio: (M-x)........................x.................x
Calculando a constante de equilíbrio, que apresenta ordem pequena:
Sendo [OH-] = [C6H5COOH] = x e [C6H5COO-] = (M-x)
Sendo Kh de ondem muito pequena, infere-se que x< < < M, logo:

schow- Jedi

- Mensagens : 446
Data de inscrição : 03/01/2013
Idade : 29
Localização : Fortaleza-CE
 Re: pH e Hidrólise.
Re: pH e Hidrólise.
ficou muito bom schow.
Obrigado se me ajudou muito
Obrigado se me ajudou muito

spawnftw- Mestre Jedi

- Mensagens : 799
Data de inscrição : 14/05/2013
Idade : 28
Localização : Campinas, São Paulo
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












