Ligações Químicas
2 participantes
Página 1 de 1
 Ligações Químicas
Ligações Químicas
Boa noite pessoal!
Alguém pode me explicar por favor "passo-a-passo" como contar o número de ligações "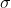 " e "π", no ácido oxálico (H2C2O4)?
" e "π", no ácido oxálico (H2C2O4)?
Eu já estudei os tipos de ligações, mas na hora de montar a estrutura de Lewis e achar as ligações duplas(se for o caso), não estou conseguindo!
Agradeço desde já!
Alguém pode me explicar por favor "passo-a-passo" como contar o número de ligações "
Eu já estudei os tipos de ligações, mas na hora de montar a estrutura de Lewis e achar as ligações duplas(se for o caso), não estou conseguindo!
Agradeço desde já!

Nat'- Mestre Jedi

- Mensagens : 795
Data de inscrição : 13/06/2012
Idade : 30
Localização : São José dos Campos - SP , Brasil
 Re: Ligações Químicas
Re: Ligações Químicas
Repare na "geometria" dos orbitais atômicos (s-p-d-f) e nos orbitais moleculares:

 "d" + "d" --> "δ"
"d" + "d" --> "δ"
A ligação molecular "σ" (sigma --> "s" latino) ganhou esse nome pelo motivo de que, quando olhada por baixo do seu eixo de união, lembra geometricamente o orbital atômico do tipo "s".
Idem para as ligações "∏" (pi --> "p" latino) e , "δ" (delta --> "d" latino).
Idem-idem, para as teóricas " " (fi) e "
" (fi) e " " (gama)
" (gama)



As distâncias , são, em ordem decrescente:
σ >∏ > δ (> φ > γ > ...)
O que decorre da maior interpenetraçãodos orbitais atômicos dos tipos "s-p-d-f-g-..." nas formações dos respectivos orbitais moleculares "σ-∏-δ-φ-γ...", crescente da esquerda para direita.
Para saber o número de ligações de cada tipo, podemos estudar as ligações moleculares verificando quais orbitais atôimcos de cada átomo participa na ligação química para formar a molécula.
Ou, o que é mais rápido, (decorar) via de regra, o seguinte:
Ligação Simples: 1 σ
Ligação Dupla: 1 σ + 1 ∏
Ligação Tripla: 1 σ + 2 ∏
Ligação Quádrupla: 1 σ + 2 ∏+ 1 δ
Sabido isso, nos resta fazer a estrutura.
Ou fazemos a distribuição eletrônica de cada átomo envolvido pelo "s-p-d-f" e pensamos, ou, mais rapidamente, sabendo-se o grupo a que pertencem os elementos, usamos a valência:
Para isso lembre-se de que:
H– : valência 1 (monovalente)
O= : valência 2 (bivalente)
|
–C– : valência 4 (tetravalente)
|
Etc...
No caso do Ácido Oxálico, H2C2O4:
Começamos com o elemento que não é o "O" nem o "H", i.e., com o característico: o "C" tetravalente:
| |
–C–C–
| |
Já "casamos" 2, faltam os "Hs" e os "Os".
Basta botar o separador de orelhas pra funcionar !
Vamos Lá !
O O
|| ||
H – O – C – C – O – H
Prontinho ! Cada um com seu cada qual !
Quando estamos "careca de fazer", omitimos algumas coisas pra ganhar tempo e poupar caneta.
O "C" vira uma quina, quebrada de reta...
O "OH" subentende-se ter uma simples, unindo-os...

E tentamos colocar da maneira que a natureza bota pra gente: o mais simétrico possível, pois, sempre que isso ocorre, temos coisas mais estáveis, ou seja, com menor energia interna.
Agora é contar ( melhor na estrutura mais detalhada, pra não se confundir, né ?!? ):
Ligações simples: 5 --> 5 σ
Ligações duplas: 2 ---> 2 σ + 2 ∏
------------------------------------
Totais: ---------------> 7 σ + 2 ∏
Sabe como eu guardo que a ligação Pi tem algo a haver com a dupla ??? :face: ???
Imagino o Pi "deitado" → ∏→ =|
→ ∏→ =|
Mas pode ser outra mnemônica qualquer...
Saudações covalentes !

 "d" + "d" --> "δ"
"d" + "d" --> "δ"A ligação molecular "σ" (sigma --> "s" latino) ganhou esse nome pelo motivo de que, quando olhada por baixo do seu eixo de união, lembra geometricamente o orbital atômico do tipo "s".
Idem para as ligações "∏" (pi --> "p" latino) e , "δ" (delta --> "d" latino).
Idem-idem, para as teóricas "
 " (fi) e "
" (fi) e " " (gama)
" (gama)


As distâncias , são, em ordem decrescente:
σ >∏ > δ (> φ > γ > ...)
O que decorre da maior interpenetraçãodos orbitais atômicos dos tipos "s-p-d-f-g-..." nas formações dos respectivos orbitais moleculares "σ-∏-δ-φ-γ...", crescente da esquerda para direita.
Para saber o número de ligações de cada tipo, podemos estudar as ligações moleculares verificando quais orbitais atôimcos de cada átomo participa na ligação química para formar a molécula.
Ou, o que é mais rápido, (decorar) via de regra, o seguinte:
Ligação Simples: 1 σ
Ligação Dupla: 1 σ + 1 ∏
Ligação Tripla: 1 σ + 2 ∏
Ligação Quádrupla: 1 σ + 2 ∏+ 1 δ
Sabido isso, nos resta fazer a estrutura.
Ou fazemos a distribuição eletrônica de cada átomo envolvido pelo "s-p-d-f" e pensamos, ou, mais rapidamente, sabendo-se o grupo a que pertencem os elementos, usamos a valência:
Para isso lembre-se de que:
H– : valência 1 (monovalente)
O= : valência 2 (bivalente)
|
–C– : valência 4 (tetravalente)
|
Etc...
No caso do Ácido Oxálico, H2C2O4:
Começamos com o elemento que não é o "O" nem o "H", i.e., com o característico: o "C" tetravalente:
| |
–C–C–
| |
Já "casamos" 2, faltam os "Hs" e os "Os".
Basta botar o separador de orelhas pra funcionar !
Vamos Lá !
O O
|| ||
H – O – C – C – O – H
Prontinho ! Cada um com seu cada qual !
Quando estamos "careca de fazer", omitimos algumas coisas pra ganhar tempo e poupar caneta.
O "C" vira uma quina, quebrada de reta...
O "OH" subentende-se ter uma simples, unindo-os...

E tentamos colocar da maneira que a natureza bota pra gente: o mais simétrico possível, pois, sempre que isso ocorre, temos coisas mais estáveis, ou seja, com menor energia interna.
Agora é contar ( melhor na estrutura mais detalhada, pra não se confundir, né ?!? ):
Ligações simples: 5 --> 5 σ
Ligações duplas: 2 ---> 2 σ + 2 ∏
------------------------------------
Totais: ---------------> 7 σ + 2 ∏
Sabe como eu guardo que a ligação Pi tem algo a haver com a dupla ??? :face: ???
Imagino o Pi "deitado"
 → ∏→ =|
→ ∏→ =|Mas pode ser outra mnemônica qualquer...
Saudações covalentes !
Última edição por rihan em Ter 28 Ago 2012, 16:33, editado 2 vez(es)
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: Ligações Químicas
Re: Ligações Químicas
Mestre rihan,
Me restou uma dúvida quanto ao número de ligação duplas...
Por exemplo no H2C2O4, eu estava considerando duas ligações duplas ao invés de quatro!
Vê se eu entendi...
Quando tiver = (ligação dupla) eu considero como duas ligações duplas??
Por exemplo, no HNO3:
856 O
758 |
O = N – O – H
Na hora de contar as ligações, eu considero: uma ou duas ligações duplas??
Me restou uma dúvida quanto ao número de ligação duplas...
Por exemplo no H2C2O4, eu estava considerando duas ligações duplas ao invés de quatro!
Vê se eu entendi...
Quando tiver = (ligação dupla) eu considero como duas ligações duplas??
Por exemplo, no HNO3:
856 O
758 |
O = N – O – H
Na hora de contar as ligações, eu considero: uma ou duas ligações duplas??

Nat'- Mestre Jedi

- Mensagens : 795
Data de inscrição : 13/06/2012
Idade : 30
Localização : São José dos Campos - SP , Brasil
 Re: Ligações Químicas
Re: Ligações Químicas
Nat' ,
Eu surtei, pirei na contagem !
Esse lance de alinhar... me deixou zonzinho !
Vamos lá:
O O
|| ||
H – O – C – C – O – H
Simples: 5 --> 5 Sigmas
Duplas: 2 --> 2 Sigmas + 2 Pis
-------------------------------
------------> 7 Sigmas + 2 Pis
Vou consertar meu erro no 1º post...
Saudações corretivas !
Eu surtei, pirei na contagem !
Esse lance de alinhar... me deixou zonzinho !
Vamos lá:
O O
|| ||
H – O – C – C – O – H
Simples: 5 --> 5 Sigmas
Duplas: 2 --> 2 Sigmas + 2 Pis
-------------------------------
------------> 7 Sigmas + 2 Pis
Vou consertar meu erro no 1º post...
Saudações corretivas !
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: Ligações Químicas
Re: Ligações Químicas
Prontinho !
Já corrigi os erros do 1º post.
Agora tá certinho !
Valeu pela atenção !
Já corrigi os erros do 1º post.
Agora tá certinho !
Valeu pela atenção !
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Re: Ligações Químicas
Re: Ligações Químicas
Muuuuito Obrigada pela explicação mestre! 
Me ajudou bastante, clareou a minha mente!


Me ajudou bastante, clareou a minha mente!

Nat'- Mestre Jedi

- Mensagens : 795
Data de inscrição : 13/06/2012
Idade : 30
Localização : São José dos Campos - SP , Brasil
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Tópicos semelhantes
Tópicos semelhantes» Ligações químicas - Estrutura e ligações do NO2
» Ligações Químicas
» Ligações Químicas
» Ligações Químicas
» Ligações químicas
» Ligações Químicas
» Ligações Químicas
» Ligações Químicas
» Ligações químicas
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












