Termodinâmica
2 participantes
PiR2 :: Física :: Termologia
Página 1 de 1
 Termodinâmica
Termodinâmica
Olá , pessoal queria uma ajuda na questão abaixo coloquei do jeito que eu estava fazendo.O passo A não tou acertando com a resposta.
Calcule o trabalho para cada um dos processos.Uma amostra de gás em um cilindro com m pistão,com um volume inicial de 3,42 L a 298 K e pressão de 2,57 atm se expande até um volume final de 7,39 L por dois caminhos diferentes Dado : 1 L*atm = 101,325 J )O caminho A é isotérmico,expanção reversível.O caminho B envolve dois passos.No primeiro passo,o gás é resfriado a volume constante até 1,19 atm.No segundo passo,o gás é aquecido e permite-se que ele se expanda contra uma pressão externa constante de 1,19 atm até o volume final de 7,39 L.
Dado : 1 L*atm = 101,325 J )O caminho A é isotérmico,expanção reversível.O caminho B envolve dois passos.No primeiro passo,o gás é resfriado a volume constante até 1,19 atm.No segundo passo,o gás é aquecido e permite-se que ele se expanda contra uma pressão externa constante de 1,19 atm até o volume final de 7,39 L.
Fiz o caminho A mais deu errado a resposta que afirma -1,91 kJ
Para o caminho A , calculei o número de mols :
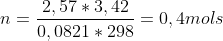
Apliquei na fórmula do trabalho para expanção reversível isotérmico
=-0,4*8,321*298*en(\frac{7,39}{3,42})=-0,76 kJ)
Para o caminho B : As resposta bate
1º Passo : W = 0 -------> volume constante
2º Passo :W = -p*∆V = -1,19*(7,39-3,42)*101,325 = -478,7 J
Questão movida. Atente para as sessões do fórum referentes a cada assunto.
Calcule o trabalho para cada um dos processos.Uma amostra de gás em um cilindro com m pistão,com um volume inicial de 3,42 L a 298 K e pressão de 2,57 atm se expande até um volume final de 7,39 L por dois caminhos diferentes
Fiz o caminho A mais deu errado a resposta que afirma -1,91 kJ
Para o caminho A , calculei o número de mols :
Apliquei na fórmula do trabalho para expanção reversível isotérmico
Para o caminho B : As resposta bate
1º Passo : W = 0 -------> volume constante
2º Passo :W = -p*∆V = -1,19*(7,39-3,42)*101,325 = -478,7 J
Questão movida. Atente para as sessões do fórum referentes a cada assunto.
Paulo- Iniciante
- Mensagens : 21
Data de inscrição : 10/04/2011
Idade : 32
Localização : Paraiba
 Re: Termodinâmica
Re: Termodinâmica
Qual a resposta do Processo A ??
Aonde tem essa resposta como sendo 1,9 Kj ??
no processo A, encontrei outro valor, poderia postar aqui pfvr !!
Aonde tem essa resposta como sendo 1,9 Kj ??
no processo A, encontrei outro valor, poderia postar aqui pfvr !!
douglassalgado- Iniciante
- Mensagens : 1
Data de inscrição : 24/12/2016
Idade : 26
Localização : Gravatá, PE, Brasil
PiR2 :: Física :: Termologia
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













