UEL - Distribuição eletrônica
2 participantes
Página 1 de 1
 UEL - Distribuição eletrônica
UEL - Distribuição eletrônica
Por meio da configuração eletrônica dos átomos dos elementos químicos, é possível caracterizar algumas de suas propriedades. Considere as configurações eletrônicas dos átomos, em seu estado fundamental, dos seguintes elementos químicos:
Elemento X = 1s2 – 2s2 – 2p6 – 3s2
Elemento Y = 1s2 – 2s2 – 2p6 – 3s2 – 3p5
Elemento W = 1s2 – 2s2 – 2p6 – 3s2 – 3p6
Elemento Z = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s1
Em relação aos dados apresentados, é correto afirmar:
a) Dentre os átomos apresentados, o átomo X apresenta a menor energia de ionização.
b) O ganho de um elétron pelo átomo Y ocorre com absorção de energia.
c) O átomo Y tem maior raio que o átomo X.
d) O íon Z+ é isoeletrônico ao íon W −
e) A ligação química entre o átomo X e o átomo Y é do tipo eletrostática
Boa noite, gostaria da explicação das alternativas fiquei em dúvida em algumas
Elemento X = 1s2 – 2s2 – 2p6 – 3s2
Elemento Y = 1s2 – 2s2 – 2p6 – 3s2 – 3p5
Elemento W = 1s2 – 2s2 – 2p6 – 3s2 – 3p6
Elemento Z = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s1
Em relação aos dados apresentados, é correto afirmar:
a) Dentre os átomos apresentados, o átomo X apresenta a menor energia de ionização.
b) O ganho de um elétron pelo átomo Y ocorre com absorção de energia.
c) O átomo Y tem maior raio que o átomo X.
d) O íon Z+ é isoeletrônico ao íon W −
e) A ligação química entre o átomo X e o átomo Y é do tipo eletrostática
- GABARITO:
- E
Boa noite, gostaria da explicação das alternativas fiquei em dúvida em algumas
Última edição por Ana Laura Guimarães em Sáb 29 Jan 2022, 16:48, editado 1 vez(es)
 Re: UEL - Distribuição eletrônica
Re: UEL - Distribuição eletrônica
Para essa questão, imagine a tabela periódica na cabeça. Não sei se a UEL fornece.
1) n = 3 --> 3o período
Termina em s2 = 2A
2) n = 3 = 3 período
Termina em p5 = 7A
Faça para o resto.
a) Energia de ionização aumenta pra cima e pra direita, não é o X
b) O Y é o ametal, ou seja, ele se estabiliza ao ganhar elétrons. Como a forma estável é a menos energética, ao ganhar elétrons ele libera energia.
c) Raio atômico aumenta pra baixo e pra esquerda.
d) Isoeletrônico = mesmo n de elétrons. Z+ = Z quando perde 1 = 18e
W- = W quando ganha 1e = 19
e) Sim, X é metal e Y é ametal, formando uma ligação iônica, que é mantida pela atração eletrostática, com base na Lei de Coullomb
1) n = 3 --> 3o período
Termina em s2 = 2A
2) n = 3 = 3 período
Termina em p5 = 7A
Faça para o resto.
a) Energia de ionização aumenta pra cima e pra direita, não é o X
b) O Y é o ametal, ou seja, ele se estabiliza ao ganhar elétrons. Como a forma estável é a menos energética, ao ganhar elétrons ele libera energia.
c) Raio atômico aumenta pra baixo e pra esquerda.
d) Isoeletrônico = mesmo n de elétrons. Z+ = Z quando perde 1 = 18e
W- = W quando ganha 1e = 19
e) Sim, X é metal e Y é ametal, formando uma ligação iônica, que é mantida pela atração eletrostática, com base na Lei de Coullomb

gusborgs- Mestre Jedi

- Mensagens : 715
Data de inscrição : 27/08/2021
 Re: UEL - Distribuição eletrônica
Re: UEL - Distribuição eletrônica

Olha, se é 2A - X ele não estaria mais para a esquerda e assim teria menor energia de ionização?
 Re: UEL - Distribuição eletrônica
Re: UEL - Distribuição eletrônica
X = 12 protons = Mg
Z = 19 protons = K
K = K = 4o período e família IA, sendo mais pra baixo e para esquerda do que o X = Mg, por isso com menor energia de ionização
Z = 19 protons = K
K = K = 4o período e família IA, sendo mais pra baixo e para esquerda do que o X = Mg, por isso com menor energia de ionização

gusborgs- Mestre Jedi

- Mensagens : 715
Data de inscrição : 27/08/2021
 Re: UEL - Distribuição eletrônica
Re: UEL - Distribuição eletrônica
Irei montar o raciocínio aqui para caso alguém procure a resolução dessa questão :]
Elemento X = 1s2 – 2s2 – 2p6 – 3s2 -> 12 Mg
Elemento Y = 1s2 – 2s2 – 2p6 – 3s2 – 3p5 -> 17 Cl
Elemento W = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 -> 18 Ar
Elemento Z = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s1 -> 19 K
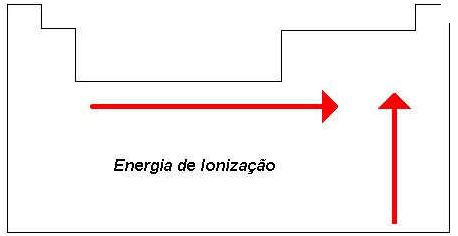

Mg Período 3 - Família 2
K Período 4 - Família 1
A) Incorreta - K tem menor energia de ionização que o Mg
B) Incorreto - Libera Energia
1s2 – 2s2 – 2p6 – 3s2 – 3p5 -> Necessita de 1 elétron para a regra do Octeto ( 8 elétrons na Camada de Valência) .
“O elétron mais facilmente removível é aquele menos firmemente preso ao núcleo, e de mais alta energia”
Como o Cloro é um Ânion ( ganha elétrons para ficar estável) ele LIBERA energia, pois se ele absorvesse energia (suficiente) seu elétron iria para outro nível e assim estaria propenso a perder elétrons ( Cátion) .
C - Incorreto

Y - Cloro (Cl)
X- Magnésio (Mg)
Ambos em mesmo Período, Porém o Mg está na Família 2A / 2, ou seja mais para a esquerda e portanto, tem maior raio atômico
D- Incorreto
Isoeletrônico mesmo número de elétrons
Z+ = Cátion : perde 1 elétron
W- = ânion : ganha um elétron
Elemento W = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 : 18 elétrons
18 + 1 = 19 elétrons
Elemento Z = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s1 : 19 elétrons
19 - 1 = 18 elétrons
Assim, eles tem diferentes números de elétrons = não são isoletrônicos
E ) Correta
"X é metal e Y é ametal, formando uma ligação iônica, que é mantida pela atração eletrostática, com base na Lei de Coulomb"
Elemento X = 1s2 – 2s2 – 2p6 – 3s2 -> 12 Mg
Elemento Y = 1s2 – 2s2 – 2p6 – 3s2 – 3p5 -> 17 Cl
Elemento W = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 -> 18 Ar
Elemento Z = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s1 -> 19 K


Mg Período 3 - Família 2
K Período 4 - Família 1
A) Incorreta - K tem menor energia de ionização que o Mg
B) Incorreto - Libera Energia
1s2 – 2s2 – 2p6 – 3s2 – 3p5 -> Necessita de 1 elétron para a regra do Octeto ( 8 elétrons na Camada de Valência) .
“O elétron mais facilmente removível é aquele menos firmemente preso ao núcleo, e de mais alta energia”
Como o Cloro é um Ânion ( ganha elétrons para ficar estável) ele LIBERA energia, pois se ele absorvesse energia (suficiente) seu elétron iria para outro nível e assim estaria propenso a perder elétrons ( Cátion) .
C - Incorreto

Y - Cloro (Cl)
X- Magnésio (Mg)
Ambos em mesmo Período, Porém o Mg está na Família 2A / 2, ou seja mais para a esquerda e portanto, tem maior raio atômico
D- Incorreto
Isoeletrônico mesmo número de elétrons
Z+ = Cátion : perde 1 elétron
W- = ânion : ganha um elétron
Elemento W = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 : 18 elétrons
18 + 1 = 19 elétrons
Elemento Z = 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s1 : 19 elétrons
19 - 1 = 18 elétrons
Assim, eles tem diferentes números de elétrons = não são isoletrônicos
E ) Correta
"X é metal e Y é ametal, formando uma ligação iônica, que é mantida pela atração eletrostática, com base na Lei de Coulomb"
( Não sei se a explicação da B está correta, dei uma pesquisada aqui, se puder dá uma conferida )
Muito obrigada pela ajuda, esclareceu demais aqui 
 Tópicos semelhantes
Tópicos semelhantes» Distribuição eletrônica
» Distribuição eletrônica
» (FEI) Distribuição Eletrônica
» distribuição eletrónica
» Distribuição Eletrônica
» Distribuição eletrônica
» (FEI) Distribuição Eletrônica
» distribuição eletrónica
» Distribuição Eletrônica
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












