UERJ-2007 - Cinética química
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 UERJ-2007 - Cinética química
UERJ-2007 - Cinética química
(UERJ-2007)Em um experimento realizado em um reator fechado e na presença de um catalisador, sob condições controladas de temperatura e pressão, verificou-se a velocidade da seguinte reação:
Admita que a reação se comporte segundo a lei da ação das massas e que sua constante de equilíbrio seja igual a 6,4.10² mol-2.L².
Determine o tempo decorrido, em minutos, entre o início da reação e o momento em que o estado de equilíbrio é atingido. Em seguida, explique a consequência da retirada do catalisador sobre valor da constante de equilíbrio.
Gabarito: T = 0,4min. Não há alteração do valor numérico da constante de equilíbrio, já que o efeito do catalisador seria apenas sobre a velocidade do processo, não afetando o equilíbrio.
Encontrei essa questão nesse tópico https://pir2.forumeiros.com/t117954-cinetica-quimica; entendi todo o raciocínio, porém não assimilei o porque da divisão do delta(NH3) por 2.
Além do mais, não compreendi a parte da alteração da constante de equilíbrio. O catalisador não deveria influenciar na equação da velocidade?
Se puderem me ajudar, agradeço. Obrigado.
N2 + 3H2 → 2NH3
Um cronômetro foi disparado no momento em que os reagentes foram postos em contato. Decorrido um determinado tempo T, foi atingido o estado de equilíbrio. A velocidade média da reação no período de tempo T foi igual a 0,10 mol.L-1.min-1. No estado de equilíbrio, as concentrações de dos reagentes nitrogênio e hidrogênio eram, respectivamente, 1,0.10-2 mol.L-1 e 1,0.10-1 mol.L-1.Admita que a reação se comporte segundo a lei da ação das massas e que sua constante de equilíbrio seja igual a 6,4.10² mol-2.L².
Determine o tempo decorrido, em minutos, entre o início da reação e o momento em que o estado de equilíbrio é atingido. Em seguida, explique a consequência da retirada do catalisador sobre valor da constante de equilíbrio.
Gabarito: T = 0,4min. Não há alteração do valor numérico da constante de equilíbrio, já que o efeito do catalisador seria apenas sobre a velocidade do processo, não afetando o equilíbrio.
Encontrei essa questão nesse tópico https://pir2.forumeiros.com/t117954-cinetica-quimica; entendi todo o raciocínio, porém não assimilei o porque da divisão do delta(NH3) por 2.
Além do mais, não compreendi a parte da alteração da constante de equilíbrio. O catalisador não deveria influenciar na equação da velocidade?
Se puderem me ajudar, agradeço. Obrigado.
Genesaoquadrado- Iniciante
- Mensagens : 1
Data de inscrição : 07/08/2017
Idade : 27
Localização : São Paulo, SP - Brasil
 Re: UERJ-2007 - Cinética química
Re: UERJ-2007 - Cinética química
Sobre a divisão,explicação nesse link: http://www.soq.com.br/conteudos/em/cineticaquimica/p1.php
Catalisador só muda o TEMPO até chegar no equilíbrio. Observe o gráfico abaixo:
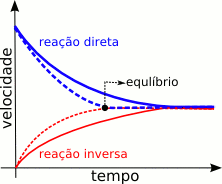
Catalisador só muda o TEMPO até chegar no equilíbrio. Observe o gráfico abaixo:

pedrim27- Mestre Jedi

- Mensagens : 517
Data de inscrição : 30/10/2014
Idade : 26
Localização : Minas Gerais,Brasil
 Tópicos semelhantes
Tópicos semelhantes» Uerj- cinética química
» Cinética Química - Leis integrais da Cinética
» UERJ 2007
» UERJ 2007
» Uerj 2007
» Cinética Química - Leis integrais da Cinética
» UERJ 2007
» UERJ 2007
» Uerj 2007
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












