Uerj- cinética química
2 participantes
Página 1 de 1
 Uerj- cinética química
Uerj- cinética química
A reação expressa pela equação
x X + y Y -> z Z + w W
foi realizada em diversas experiências nas quais se manteve constante a temperatura. As velocidades de reação foram medidas, variando-se a concentração molar de um dos reagentes e mantendo-se a do outro constante. Os resultados obtidos estão representados no gráfico:
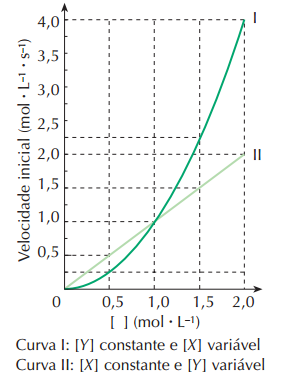
Em função dos dados apresentados:
a) determine a ordem da reação
em relação aos reagentes X e Y, respectivamente;
b) calcule o número de vezes em que a velocidade da
reação aumenta quando se duplica a concentração
molar de Y e se triplica a concentração molar de X.
É correto resolver A desta forma? :suspect:
0,5/1= 0,5a * 1b / 0,5b * 1a
0,5/1= 0,5a/1a= 1b/0,5b
0,5/1 = 1/2a = 2b
0,5/1= 1/2 *2a= 2*2b
0,5/1= 1a=4b
0,5/1*4b
4*0,5= 2b
E como resolver a B?
x X + y Y -> z Z + w W
foi realizada em diversas experiências nas quais se manteve constante a temperatura. As velocidades de reação foram medidas, variando-se a concentração molar de um dos reagentes e mantendo-se a do outro constante. Os resultados obtidos estão representados no gráfico:

Em função dos dados apresentados:
a) determine a ordem da reação
em relação aos reagentes X e Y, respectivamente;
b) calcule o número de vezes em que a velocidade da
reação aumenta quando se duplica a concentração
molar de Y e se triplica a concentração molar de X.
É correto resolver A desta forma? :suspect:
0,5/1= 0,5a * 1b / 0,5b * 1a
0,5/1= 0,5a/1a= 1b/0,5b
0,5/1 = 1/2a = 2b
0,5/1= 1/2 *2a= 2*2b
0,5/1= 1a=4b
0,5/1*4b
4*0,5= 2b
E como resolver a B?
mari- Estrela Dourada

- Mensagens : 1134
Data de inscrição : 01/09/2015
Idade : 26
Localização : São Paulo
 Re: Uerj- cinética química
Re: Uerj- cinética química
A)
A ordem das reações pode ser facilmente obtida olhando a relação entre a concentração e a velocidade. Se você tem apenas uma das concentrações dos reagentes variando e, juntamente com isso, a velocidade da reação, então você pode obter uma relação entre esses dois valores. Como na curva I (x variável) uma concentração de 2 unidades está associada a uma velocidade de 4 unidades e uma concentração de 1 unidade está associada a uma velocidade de 1 unidade, calcula-se a ordem de x como sendo igual a 2 (1 elevado a 2 = 1 e 2 elevado a 2 = 4). Fazendo o mesmo para y com a curva II (y variável) obtêm-se a ordem 1.
B)
Dobrando a concentração de y (que tem ordem 1) ocorrerá o mesmo com a velocidade, e triplicando a concentração de x (que tem ordem 2) ocorrerá um aumento de 9 vezes na velocidade (3 elevado ao quadrado). Como a equação da velocidade é V = [X]٨2 x [Y]٨1, tem-se um aumento de 18 vezes na velocidade.
Tudo pode ser facilmente entendido se você compreender que a velocidade da reação é expressa pela multiplicação das concentrações dos reagentes elevadas a expoentes chamados de ordem (V = [Z]٨a x [H]٨b x ...), os quais servem para indicar como a velocidade varia de acordo com a mudança de concentração daquele reagente(por isso tens que analisar o gráfico e considerar todos os outros reagentes não analisados como constantes).
A ordem das reações pode ser facilmente obtida olhando a relação entre a concentração e a velocidade. Se você tem apenas uma das concentrações dos reagentes variando e, juntamente com isso, a velocidade da reação, então você pode obter uma relação entre esses dois valores. Como na curva I (x variável) uma concentração de 2 unidades está associada a uma velocidade de 4 unidades e uma concentração de 1 unidade está associada a uma velocidade de 1 unidade, calcula-se a ordem de x como sendo igual a 2 (1 elevado a 2 = 1 e 2 elevado a 2 = 4). Fazendo o mesmo para y com a curva II (y variável) obtêm-se a ordem 1.
B)
Dobrando a concentração de y (que tem ordem 1) ocorrerá o mesmo com a velocidade, e triplicando a concentração de x (que tem ordem 2) ocorrerá um aumento de 9 vezes na velocidade (3 elevado ao quadrado). Como a equação da velocidade é V = [X]٨2 x [Y]٨1, tem-se um aumento de 18 vezes na velocidade.
Tudo pode ser facilmente entendido se você compreender que a velocidade da reação é expressa pela multiplicação das concentrações dos reagentes elevadas a expoentes chamados de ordem (V = [Z]٨a x [H]٨b x ...), os quais servem para indicar como a velocidade varia de acordo com a mudança de concentração daquele reagente(por isso tens que analisar o gráfico e considerar todos os outros reagentes não analisados como constantes).
Tapuiapega- Iniciante
- Mensagens : 3
Data de inscrição : 18/12/2015
Idade : 25
Localização : Brasil
 Re: Uerj- cinética química
Re: Uerj- cinética química
Certo, entendi sua resolução, obrigada.
A forma algébrica está correta? Já utilizei para resolver outros exercícios e queria saber se posso empregar neste também...
A forma algébrica está correta? Já utilizei para resolver outros exercícios e queria saber se posso empregar neste também...
mari- Estrela Dourada

- Mensagens : 1134
Data de inscrição : 01/09/2015
Idade : 26
Localização : São Paulo
 Tópicos semelhantes
Tópicos semelhantes» UERJ - Química (Estequiometria)
» Cinética Química - Leis integrais da Cinética
» (UERJ) Energia cinética?
» Química - UERJ
» UERJ - Específica de química
» Cinética Química - Leis integrais da Cinética
» (UERJ) Energia cinética?
» Química - UERJ
» UERJ - Específica de química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












