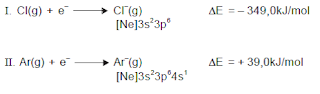Propriedade periódica
3 participantes
Página 1 de 1
 Propriedade periódica
Propriedade periódica
A afinidade eletrônica é a variação de energia que ocorre quando um elétron é adicionado a um átomo gasoso. Para muitos átomos a energia é liberada durante esse processo, entretanto para outros a energia é absorvida, como mostram as equações químicas I e II, que representam as afinidades eletrônicas do cloro e do argônio. A partir da análise dessas informações e dos dados da tabela, é correto afirmar:
01) A configuração eletrônica de Ar−(g) indica que esse ânion é mais estável que o átomo de argônio gasoso de configuração eletrônica, representada por [Ne]3s23p6.
02) O ânion Mg−(g), de configuração eletrônica representada por [Ne]3s23p1, é menos estável que o ânion Ca−(g), de configuração eletrônica representada por [Ar]4s23d1.
03) A estabilidade dos ânions gasosos dos elementos químicos do grupo periódico 1 aumenta com o aumento do número atômico.
04) O composto iônico Li+Ne−(g) é mais estável que o composto Li+Cl−(g).
05) O ânion Cl−(g) é menos estável que o ânion Rb−(g).
01) A configuração eletrônica de Ar−(g) indica que esse ânion é mais estável que o átomo de argônio gasoso de configuração eletrônica, representada por [Ne]3s23p6.
02) O ânion Mg−(g), de configuração eletrônica representada por [Ne]3s23p1, é menos estável que o ânion Ca−(g), de configuração eletrônica representada por [Ar]4s23d1.
03) A estabilidade dos ânions gasosos dos elementos químicos do grupo periódico 1 aumenta com o aumento do número atômico.
04) O composto iônico Li+Ne−(g) é mais estável que o composto Li+Cl−(g).
05) O ânion Cl−(g) é menos estável que o ânion Rb−(g).
Gabarito 02 Como eu sei que é menos estável ? Qual propriedade periódica se refere a isso ?
Obrigado
Obrigado
APSmed- Mestre Jedi

- Mensagens : 580
Data de inscrição : 21/04/2014
Idade : 27
Localização : Bahia
 Re: Propriedade periódica
Re: Propriedade periódica
A propriedade periódica referida é o aumento do número atômico, que assume valores regulares durante a tabela.
Existe uma regra que diz o seguinte :
A energia dos subníveis decresce com o aumento do número atômico, em decorrência do aumento da força atrativa nuclear. A partir do número atômico 21, pode ficar invertida a ordem energética de alguns subníveis.
Portanto o ânion Cálcio está em uma forma mais baixa de energia em comparação com a configuração do ânion Magnésio.
Existe uma regra que diz o seguinte :
A energia dos subníveis decresce com o aumento do número atômico, em decorrência do aumento da força atrativa nuclear. A partir do número atômico 21, pode ficar invertida a ordem energética de alguns subníveis.
Portanto o ânion Cálcio está em uma forma mais baixa de energia em comparação com a configuração do ânion Magnésio.

Oziel- Estrela Dourada

- Mensagens : 1517
Data de inscrição : 26/04/2016
Idade : 25
Localização : São Pedro da Aldeia-RJ
 Re: Propriedade periódica
Re: Propriedade periódica
Afinidade eletrônica é a energia liberada quando se adiciona um elétron a um átomo isolado no estado gasoso. Percebe-se que a energia liberada, nesse processo, para o cálcio, é de 2 kJ/mol (o sinal de - significa que a energia foi liberada); para o magnésio, a energia "liberada" será negativa, ou seja, é preciso fornecer energia (por isso que na tabela ela está >0) para que um elétron seja adicionado ao seu átomo na fase de gás (o que se verifica facilmente quando se adicionam elétrons a gases nobres). Portanto, para formar um ânion monovalente do magnésio é mais difícil do que com o cálcio. Dessa forma, Mg−(g) é menos estável do que Ca−(g).
Em suma, a propriedade periódica que se refere a isso é a Afinidade Eletrônica.
Em suma, a propriedade periódica que se refere a isso é a Afinidade Eletrônica.

Hayzel Sh- Estrela Dourada

- Mensagens : 1110
Data de inscrição : 02/04/2016
Idade : 26
Localização : Curitiba, PR
 Re: Propriedade periódica
Re: Propriedade periódica
A estabilidade do íon também se dá pela maior dispersão de carga.
Nota-se isso na força dos ácidos halogênicos, onde o HI é o mais forte. I- possui um maior raio atômico comparado ao F-. Como o I- é bem estável nesse caso (uma base fraca), seu ácido conjugado é forte.
Nota-se isso na força dos ácidos halogênicos, onde o HI é o mais forte. I- possui um maior raio atômico comparado ao F-. Como o I- é bem estável nesse caso (uma base fraca), seu ácido conjugado é forte.
Convidado- Convidado
 Tópicos semelhantes
Tópicos semelhantes» Propriedade Periódica
» Propriedade periódica
» (Nelson Santos - ITA) - Propriedade Periódica.
» Propriedade Periódica (Raio Atômico)
» Propriedade Periódica - Raio Atômico
» Propriedade periódica
» (Nelson Santos - ITA) - Propriedade Periódica.
» Propriedade Periódica (Raio Atômico)
» Propriedade Periódica - Raio Atômico
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|