Geometria molecular e polaridade
4 participantes
Página 1 de 1
 Geometria molecular e polaridade
Geometria molecular e polaridade
Um aluno utiliza, em seus estudos, uma tabela de seu livro que indica a geometria e a polaridade de algumas moléculas. Esse aluno deixa cair em seu material um pouco de café, manchando parte da tabela utilizada por ele e, consequentemente, dificultando a leitura de algumas palavras. O aluno decide, por esse motivo, copiar a página danificada em seu caderno.
As letras A, B, C, D e E na ilustração abaixo, que representa uma trecho da tabela utilizada pelo estudante, indicam as partes manchadas.
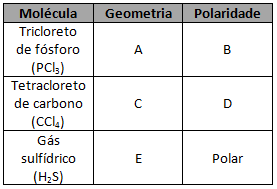
As letras A, B, C, D e E na ilustração abaixo, que representa uma trecho da tabela utilizada pelo estudante, indicam as partes manchadas.

Considere os números atômicos (Z): H = 1, C = 6, P = 15, S = 16, Cl = 17.
Ao copiar a tabela para o seu caderno, o aluno deverá substituir as letras A, B, C, D e E, respectivamente, por
A) trigonal, polar, tetraédrica, apolar e angular.
B) piramidal, apolar, piramidal, polar e linear.
C) piramidal, polar, tetraédrica, polar e angular.
D) trigonal, apolar, trigonal, apolar e linear.
E) piramidal, polar, tetraédrica, apolar e angular.
C) piramidal, polar, tetraédrica, polar e angular.
D) trigonal, apolar, trigonal, apolar e linear.
E) piramidal, polar, tetraédrica, apolar e angular.
Pessoal, eu sei que a dúvida é muito boba, mas eu não consigo resolver essa questão sem usar a tabela periódica. Alguém pode me dar uma luz sobre como resolver esse tipo de exercício sem tabela? Quando fiz com a tabela achei letra A.
RodolfoGuimaraes- Iniciante
- Mensagens : 24
Data de inscrição : 19/01/2017
Idade : 24
Localização : Pará de Minas, Minas Gerais, Brasil
 Re: Geometria molecular e polaridade
Re: Geometria molecular e polaridade
Olá RodolfoGuimaraes
Esse tipo de questão você pode resolver analisando o número de átomos e, se sobram ou não, elétrons.
2 átomos -> Linear
3 átomos:
Não sobram elétrons ao redor do átomo principal: linear
Sobram elétrons ao redor do átomo principal: angular
4 átomos:
Não sobram elétrons: Trigonal Plana
Sobram elétrons: Piramidal
5 átomos -> Tetraédrica
A partir de cinco átomos, não precisa mais analisar se sobram ou não elétrons ao redor do átomo central.
Por que a geometria muda conforme há elétrons ou não ao redor do átomo central? Por causa da Teoria de Repulsão dos Pares Eletrônicos da Camada de Valência (VSEPR). Caso tenha dúvidas, tente obter uma molécula que você saiba a geometria e desenhe-a.
Agora, pra você saber quantos elétrons há na camada de valência, faça a distribuição eletrônica do número atômico dado na própria questão.
Esse tipo de questão você pode resolver analisando o número de átomos e, se sobram ou não, elétrons.
2 átomos -> Linear
3 átomos:
Não sobram elétrons ao redor do átomo principal: linear
Sobram elétrons ao redor do átomo principal: angular
4 átomos:
Não sobram elétrons: Trigonal Plana
Sobram elétrons: Piramidal
5 átomos -> Tetraédrica
A partir de cinco átomos, não precisa mais analisar se sobram ou não elétrons ao redor do átomo central.
Por que a geometria muda conforme há elétrons ou não ao redor do átomo central? Por causa da Teoria de Repulsão dos Pares Eletrônicos da Camada de Valência (VSEPR). Caso tenha dúvidas, tente obter uma molécula que você saiba a geometria e desenhe-a.
Agora, pra você saber quantos elétrons há na camada de valência, faça a distribuição eletrônica do número atômico dado na própria questão.

karnstein- Jedi

- Mensagens : 204
Data de inscrição : 12/10/2016
Idade : 27
Localização : goiânia, goiás, brasil
 Re: Geometria molecular e polaridade
Re: Geometria molecular e polaridade
É letra E,não?

caiomslk- Jedi

- Mensagens : 453
Data de inscrição : 25/10/2016
Idade : 25
Localização : Feira de Santana, Bahia, Brasil
 Re: Geometria molecular e polaridade
Re: Geometria molecular e polaridade
Sim, é a letra E.caiomslk escreveu:É letra E,não?

karnstein- Jedi

- Mensagens : 204
Data de inscrição : 12/10/2016
Idade : 27
Localização : goiânia, goiás, brasil
 Re: Geometria molecular e polaridade
Re: Geometria molecular e polaridade
karnstein escreveu:Olá RodolfoGuimaraes
Esse tipo de questão você pode resolver analisando o número de átomos e, se sobram ou não, elétrons.
2 átomos -> Linear
3 átomos:
Não sobram elétrons ao redor do átomo principal: linear
Sobram elétrons ao redor do átomo principal: angular
4 átomos:
Não sobram elétrons: Trigonal Plana
Sobram elétrons: Piramidal
5 átomos -> Tetraédrica
A partir de cinco átomos, não precisa mais analisar se sobram ou não elétrons ao redor do átomo central.
Por que a geometria muda conforme há elétrons ou não ao redor do átomo central? Por causa da Teoria de Repulsão dos Pares Eletrônicos da Camada de Valência (VSEPR). Caso tenha dúvidas, tente obter uma molécula que você saiba a geometria e desenhe-a.
Agora, pra você saber quantos elétrons há na camada de valência, faça a distribuição eletrônica do número atômico dado na própria questão.
Muito obrigado pela resposta! Consegui montar as geometrias. Sei que isso é bobo mas o meu erro era na base. Não estava sabendo fazer bem a distribuição eletrônica e acabei confundindo geometria trigonal com piramidal. Mas, se não for pedir muito, tem como me tirar outra duvidazinha? Eu aprendi a determinar a polaridade através da análise das eletronegatividades, mas o exercício não fala nada sobre isso. Como eu determino as polaridades sem a tabela?
RodolfoGuimaraes- Iniciante
- Mensagens : 24
Data de inscrição : 19/01/2017
Idade : 24
Localização : Pará de Minas, Minas Gerais, Brasil
 Re: Geometria molecular e polaridade
Re: Geometria molecular e polaridade
Bem, de forma conceitual, é o seguinte:
molécula apolar possui 2 átomos iguais OU o átomo central possui ligantes iguais.
molécula polar é entre 2 átomos diferentes ou então a geometria é angular ou piramidal (por isso PCl3 é polar) ou o átomo central possui ligantes diferentes.
molécula apolar possui 2 átomos iguais OU o átomo central possui ligantes iguais.
molécula polar é entre 2 átomos diferentes ou então a geometria é angular ou piramidal (por isso PCl3 é polar) ou o átomo central possui ligantes diferentes.

karnstein- Jedi

- Mensagens : 204
Data de inscrição : 12/10/2016
Idade : 27
Localização : goiânia, goiás, brasil
 Re: Geometria molecular e polaridade
Re: Geometria molecular e polaridade
A molécula de PCl4 é Polar e Piramidal, pois, têm um átomo ´´sobrando´´ recebendo uma ligação Dativa e não sobrando e sobrando 1 elétron formando mais uma nuvem respectivamente.
A molécula de CCl4 é Apolar e Tetraédrica, pois, é simétrica ou os vetores se anulam, pode ser por um desses dois motivos. Ela é Tetraédrica, pois, há simetria entre os átomos.
A molécula de H2S é Polar e Angular , pois, os vetores se coincidem e há uma repulsão dos elétrons não ligantes deixando a molécula Angular.
A molécula de CCl4 é Apolar e Tetraédrica, pois, é simétrica ou os vetores se anulam, pode ser por um desses dois motivos. Ela é Tetraédrica, pois, há simetria entre os átomos.
A molécula de H2S é Polar e Angular , pois, os vetores se coincidem e há uma repulsão dos elétrons não ligantes deixando a molécula Angular.

Oziel- Estrela Dourada

- Mensagens : 1518
Data de inscrição : 26/04/2016
Idade : 26
Localização : São Pedro da Aldeia-RJ
 Tópicos semelhantes
Tópicos semelhantes» Polaridade e geometria molecular
» Polaridade e geometria molecular
» Geometria molecular e Polaridade
» Polaridade/geometria molecular
» Geometria molecular e Polaridade
» Polaridade e geometria molecular
» Geometria molecular e Polaridade
» Polaridade/geometria molecular
» Geometria molecular e Polaridade
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












