Geometria molecular!
2 participantes
Página 1 de 1
 Geometria molecular!
Geometria molecular!
No caso da molécula de SF4 sua geometria é bipirâmide trigonal ou em gangorra?Assim como a molécula de ClF3;ela é bipirâmide trigonal ou T?ou ambas estão corretas?
Encontrei algumas explicações usando um ou o outro termo para essas moléculas.
A molécula de BrF3 de estrutura semelhante a do ClF3 resolvi uma questão que a chamava de bipirâmide trigonal,contudo eu a considerava sua geometria como T,pelo fato de sua estrutura ser semelhante à do ClF3.
É correta as duas nomenclatura para essas moléculas?
Encontrei algumas explicações usando um ou o outro termo para essas moléculas.
A molécula de BrF3 de estrutura semelhante a do ClF3 resolvi uma questão que a chamava de bipirâmide trigonal,contudo eu a considerava sua geometria como T,pelo fato de sua estrutura ser semelhante à do ClF3.
É correta as duas nomenclatura para essas moléculas?
Jorge Mendes- Recebeu o sabre de luz

- Mensagens : 196
Data de inscrição : 03/10/2012
Idade : 33
Localização : Brasil
 Re: Geometria molecular!
Re: Geometria molecular!


Perceba que há uma diferença entre arranjo molecular e geometria molecular.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Geometria molecular!
Re: Geometria molecular!
Qual a diferença,não consegui identificar.Quer dizer que geometria se refere a disposição dos átomos e arranjo a disposição dos elétrons?
Jorge Mendes- Recebeu o sabre de luz

- Mensagens : 196
Data de inscrição : 03/10/2012
Idade : 33
Localização : Brasil
 Re: Geometria molecular!
Re: Geometria molecular!
Eu tenho TANTA coisa pra falar desse assunto que não sei por onde começar..
Me parece que você está sem uma teoria adequada a respeito, então descreverei alguma:
Nuvens eletrônicas ou domínios eletrônicos: pares de elétrons ligantes, par de elétron livre, ou elétron livre.
Para moléculas com 3 nuvens eletrônicas, o arranjo molecular é sempre trigonal plano. Exemplo:

Imagine que inicialmente as três nuvens eletrônicas continham 3 pares de elétrons ligantes, assim de acordo com o modelo de repulsão dos elétrons da camada de valência, os 3 pares tenderão a ficar na maior distância angular possível uns dos outros, sendo portanto ângulos de 120º.
Como temos 3 nuvens eletrônicas que contém pares de elétrons ligantes, tanto a geometria molecular como o arranjo molecular serão os mesmos: trigonal plana.
Agora imagine que uma dessas nuvens contenha um par de elétron não ligante, ora, os pares de elétrons sejam em ligações ou não, ainda vão estar em repulsão, portanto vão se dispor espacialmente na maior distância angular possível, logo a geometria dos elétrons, ou arranjo molecular continua sendo trigonal plana. Entretanto agora temos 2 ligantes que formam um ângulo entre si, então dizemos que a geometria da molécula, que leva em conta não a disposição dos elétrons espacialmente, mas sim a disposição dos átomos, será angular.
Observe a figura, temos uma molécula de geometria angular, só que os pares de elétrons ainda continuam no mesmo arranjo (trigonal plano), afinal, eles ainda estão em repulsão.
Obs: A densidade eletrônica de um par de elétron livre é maior que a de pares ligantes, portanto eles "empurram" os outros pares com uma intensidade maior que quando estão ligados, aquela geometria angular não tem um ângulo entre os átomos de 120° e sim pouco menor que isso, pois os elétrons não ligantes empurraram os elétrons ligantes com maior intensidade.
Agora vamos para moléculas com 4 nuvens eletrônicas de acordo com a figura:

Inicialmente tínhamos todos os pares de elétrons ligantes, a geometria dos elétrons (arranjo molecular) é tetraédrico e a geometria da molécula também.
Se agora, fizermos um par de elétron ligante se tornar livre, ele continuará na mesma posição que estava na ligação (com uma leve mudança devido a sua maior densidade eletrônica), não alterando portanto o arranjo molecular.
Na segunda etapa, temos uma molécula com arranjo tetraédrico e geometria piramidal. Novamente: a geometria molecular não leva em consideração a posição dos elétrons e sim a posição dos átomos que contém os pares de elétrons ligantes.
Se agora tornarmos mais um elétron ligante em não ligante, os elétrons permaneceram na mesma posição, só que a geometria molecular será angular, e o arranjo molecular continua sendo tetraédrico.
Um exemplo é água, 4 pares de elétrons, 2 ligantes e 2 não ligantes, 4 pares de elétrons vão se dispor na maior distância angular possível, o seu arranjo será tetraédrico, e os pares ligantes garantirão uma geometria molecular angular.
Em resumo: independentemente da situação dos pares de elétrons, eles sempre permanecerão na maior distância angular possível.
Para 3 pares: 120º e arranjo trigonal
Para 4 pares: 109º 28' e arranjo tetraédrico
Se esses elétrons forem ligantes ou não, isso irá determinar a geometria da molécula, pela disposição dos pares ligantes, mas os elétrons independentemente terão sempre um arranjo fixo.
Agora com 5 nuvens eletrônicas, os 5 pares de elétrons tenderão a ficar em uma disposição de maior distância angular para essa quantidade e essa disposição é o arranjo bipirâmide triangular:
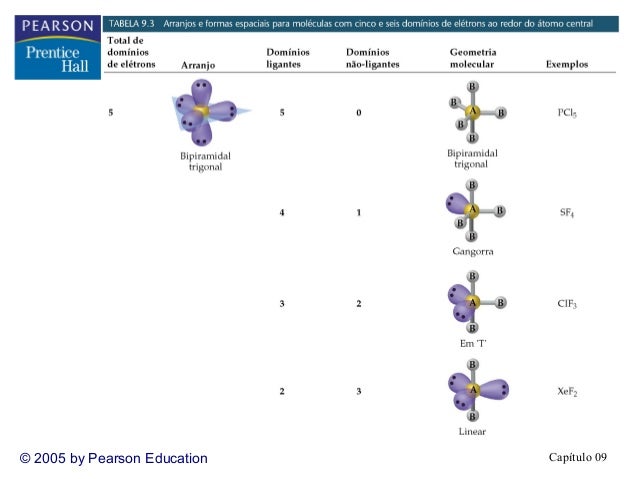
Se todos os pares de elétrons forem ligantes, o arranjo coincide com a geometria molecular: bipirâmide trigonal.
Se tornarmos um par de elétrons ligante em não ligante, os elétrons permanecerão em seus arranjos por causa da repulsão, mas a geometria da molécula será em forma de gangorra.
Se tornarmos mais um par de elétron ligante em não ligante, os elétrons permanecerão em seus arranjos por causa da repulsão, mas a geometria da molécula será em forma de T.
Se tornarmos agora o terceiro par de elétron ligante em não ligante, os elétrons permanecerão em seus arranjos (bipirâmide trigonal) por causa da repulsão natural, mas a geometria da molécula será linear.
No arranjo bipiramidal trigonal, você deve tornar os pares de elétrons ligantes em não ligantes, obrigatoriamente, aqueles pares que estiverem no plano equatorial da molécula, pois aqueles estarão a maior distância angular dos outros pares.
Se chegou até aqui, deve estar entendendo, então vamos agora para 6 nuvens:
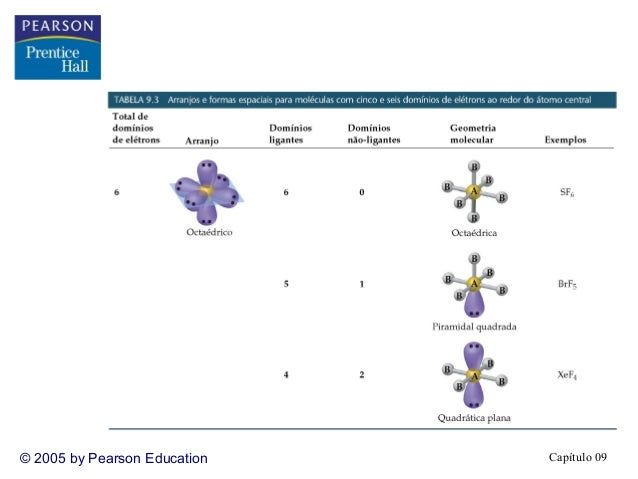
Seis pares de elétrons se colocarão espacialmente a maior distância angular possível: arranjo octaédrico.
Para oito ligantes: geometria octaédrica
Se tornarmos um ligante em não ligante, temos uma geometria molecular piramidal quadrada e um arranjo ainda octaédrico.
E assim vamos repetindo o procedimento, mais um par, temos agora a geometria molecular quadrado planar.
Ainda temos 7 nuvens eletrônicas, o arranjo será bipirâmide pentagonal.
Com 8 nuvens o arranjo será quadrado anti-prismático.
E por aí vai ...
Me parece que você está sem uma teoria adequada a respeito, então descreverei alguma:
Nuvens eletrônicas ou domínios eletrônicos: pares de elétrons ligantes, par de elétron livre, ou elétron livre.
Para moléculas com 3 nuvens eletrônicas, o arranjo molecular é sempre trigonal plano. Exemplo:

Imagine que inicialmente as três nuvens eletrônicas continham 3 pares de elétrons ligantes, assim de acordo com o modelo de repulsão dos elétrons da camada de valência, os 3 pares tenderão a ficar na maior distância angular possível uns dos outros, sendo portanto ângulos de 120º.
Como temos 3 nuvens eletrônicas que contém pares de elétrons ligantes, tanto a geometria molecular como o arranjo molecular serão os mesmos: trigonal plana.
Agora imagine que uma dessas nuvens contenha um par de elétron não ligante, ora, os pares de elétrons sejam em ligações ou não, ainda vão estar em repulsão, portanto vão se dispor espacialmente na maior distância angular possível, logo a geometria dos elétrons, ou arranjo molecular continua sendo trigonal plana. Entretanto agora temos 2 ligantes que formam um ângulo entre si, então dizemos que a geometria da molécula, que leva em conta não a disposição dos elétrons espacialmente, mas sim a disposição dos átomos, será angular.
Observe a figura, temos uma molécula de geometria angular, só que os pares de elétrons ainda continuam no mesmo arranjo (trigonal plano), afinal, eles ainda estão em repulsão.
Obs: A densidade eletrônica de um par de elétron livre é maior que a de pares ligantes, portanto eles "empurram" os outros pares com uma intensidade maior que quando estão ligados, aquela geometria angular não tem um ângulo entre os átomos de 120° e sim pouco menor que isso, pois os elétrons não ligantes empurraram os elétrons ligantes com maior intensidade.
Agora vamos para moléculas com 4 nuvens eletrônicas de acordo com a figura:

Inicialmente tínhamos todos os pares de elétrons ligantes, a geometria dos elétrons (arranjo molecular) é tetraédrico e a geometria da molécula também.
Se agora, fizermos um par de elétron ligante se tornar livre, ele continuará na mesma posição que estava na ligação (com uma leve mudança devido a sua maior densidade eletrônica), não alterando portanto o arranjo molecular.
Na segunda etapa, temos uma molécula com arranjo tetraédrico e geometria piramidal. Novamente: a geometria molecular não leva em consideração a posição dos elétrons e sim a posição dos átomos que contém os pares de elétrons ligantes.
Se agora tornarmos mais um elétron ligante em não ligante, os elétrons permaneceram na mesma posição, só que a geometria molecular será angular, e o arranjo molecular continua sendo tetraédrico.
Um exemplo é água, 4 pares de elétrons, 2 ligantes e 2 não ligantes, 4 pares de elétrons vão se dispor na maior distância angular possível, o seu arranjo será tetraédrico, e os pares ligantes garantirão uma geometria molecular angular.
Em resumo: independentemente da situação dos pares de elétrons, eles sempre permanecerão na maior distância angular possível.
Para 3 pares: 120º e arranjo trigonal
Para 4 pares: 109º 28' e arranjo tetraédrico
Se esses elétrons forem ligantes ou não, isso irá determinar a geometria da molécula, pela disposição dos pares ligantes, mas os elétrons independentemente terão sempre um arranjo fixo.
Agora com 5 nuvens eletrônicas, os 5 pares de elétrons tenderão a ficar em uma disposição de maior distância angular para essa quantidade e essa disposição é o arranjo bipirâmide triangular:

Se todos os pares de elétrons forem ligantes, o arranjo coincide com a geometria molecular: bipirâmide trigonal.
Se tornarmos um par de elétrons ligante em não ligante, os elétrons permanecerão em seus arranjos por causa da repulsão, mas a geometria da molécula será em forma de gangorra.
Se tornarmos mais um par de elétron ligante em não ligante, os elétrons permanecerão em seus arranjos por causa da repulsão, mas a geometria da molécula será em forma de T.
Se tornarmos agora o terceiro par de elétron ligante em não ligante, os elétrons permanecerão em seus arranjos (bipirâmide trigonal) por causa da repulsão natural, mas a geometria da molécula será linear.
No arranjo bipiramidal trigonal, você deve tornar os pares de elétrons ligantes em não ligantes, obrigatoriamente, aqueles pares que estiverem no plano equatorial da molécula, pois aqueles estarão a maior distância angular dos outros pares.
Se chegou até aqui, deve estar entendendo, então vamos agora para 6 nuvens:

Seis pares de elétrons se colocarão espacialmente a maior distância angular possível: arranjo octaédrico.
Para oito ligantes: geometria octaédrica
Se tornarmos um ligante em não ligante, temos uma geometria molecular piramidal quadrada e um arranjo ainda octaédrico.
E assim vamos repetindo o procedimento, mais um par, temos agora a geometria molecular quadrado planar.
Ainda temos 7 nuvens eletrônicas, o arranjo será bipirâmide pentagonal.
Com 8 nuvens o arranjo será quadrado anti-prismático.
E por aí vai ...
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Geometria molecular!
Re: Geometria molecular!
Nossa,finalmente entendi essa matéria!Ufaaaa!rs
Nunca havia tido uma explicação que me esclarece de uma vez por todas essas duvidas.Thálisson,muito obrigado por dispor seu precioso tempo para uma explicação tão detalhada para um desconhecido.Queria poder agradecer pessoalmente.Muito obrigado mesmo!
Abraços!
Nunca havia tido uma explicação que me esclarece de uma vez por todas essas duvidas.Thálisson,muito obrigado por dispor seu precioso tempo para uma explicação tão detalhada para um desconhecido.Queria poder agradecer pessoalmente.Muito obrigado mesmo!
Abraços!
Jorge Mendes- Recebeu o sabre de luz

- Mensagens : 196
Data de inscrição : 03/10/2012
Idade : 33
Localização : Brasil
 Re: Geometria molecular!
Re: Geometria molecular!
Opa, que nada amigo estamos aqui pra isso. Você entendendo e assimilando o assunto é a sua forma de me agradecer (:
Abraços.
Abraços.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Geometria molecular!
Re: Geometria molecular!
Então está agradecido!hehe!
Abraços!
Abraços!
Jorge Mendes- Recebeu o sabre de luz

- Mensagens : 196
Data de inscrição : 03/10/2012
Idade : 33
Localização : Brasil
 Tópicos semelhantes
Tópicos semelhantes» geometria molecular
» GEOMETRIA MOLECULAR
» Geometria molecular
» Geometria molecular
» Geometria molecular
» GEOMETRIA MOLECULAR
» Geometria molecular
» Geometria molecular
» Geometria molecular
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












