uefs ba
2 participantes
Página 1 de 1
 uefs ba
uefs ba
- (UEFS BA)
J. Dalton, 1766-1844, foi um cientista que se destacou nos
campos experimental e teórico da Química. Estudiosos da
História da Química acreditam que ele previu a Lei das
Proporções Múltiplas, em 1803, com base na teoria atômica que
elaborou. Segundo Dalton, se a massa fixa de uma substância
química A se combina com massas diferentes de uma substância
química B, as massas de B apresentam uma relação de números
inteiros e pequenos. Dalton também explicou com base na teoria
atômica a Lei da Conservação de Massa, de Lavoisier, e a Lei das
Proporções Constantes, de Proust. A tabela apresenta as massas
de oxigênio, O2(g), que se combinam com as de nitrogênio,
N2(g), na formação de três óxidos desse elemento químico.
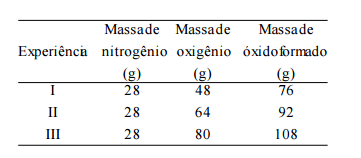
De acordo com essas informações e a partir da análise dos dados
da tabela, é correto afirmar que a
a) percentagem de nitrogênio no óxido formado em II é igual à
de nitrogênio no óxido formado em I.
b) composição em massa do óxido de nitrogênio formado em
III é de 2,0g de nitrogênio para 4,0g de oxigênio.
c) composição centesimal do óxido formado em I varia com as
massas de nitrogênio e de oxigênio que se combinam.
d) relação entre as massas de oxigênio que se combinam com
uma massa fixa de nitrogênio são, respectivamente, 3:4:5.
e) reação de 28,0g de N2(g) com 80,0g de O2(g), na
experiência III realizada em um recipiente aberto, está de
acordo com a Lei da Conservação de Massa, de Lavoisier
J. Dalton, 1766-1844, foi um cientista que se destacou nos
campos experimental e teórico da Química. Estudiosos da
História da Química acreditam que ele previu a Lei das
Proporções Múltiplas, em 1803, com base na teoria atômica que
elaborou. Segundo Dalton, se a massa fixa de uma substância
química A se combina com massas diferentes de uma substância
química B, as massas de B apresentam uma relação de números
inteiros e pequenos. Dalton também explicou com base na teoria
atômica a Lei da Conservação de Massa, de Lavoisier, e a Lei das
Proporções Constantes, de Proust. A tabela apresenta as massas
de oxigênio, O2(g), que se combinam com as de nitrogênio,
N2(g), na formação de três óxidos desse elemento químico.

De acordo com essas informações e a partir da análise dos dados
da tabela, é correto afirmar que a
a) percentagem de nitrogênio no óxido formado em II é igual à
de nitrogênio no óxido formado em I.
b) composição em massa do óxido de nitrogênio formado em
III é de 2,0g de nitrogênio para 4,0g de oxigênio.
c) composição centesimal do óxido formado em I varia com as
massas de nitrogênio e de oxigênio que se combinam.
d) relação entre as massas de oxigênio que se combinam com
uma massa fixa de nitrogênio são, respectivamente, 3:4:5.
e) reação de 28,0g de N2(g) com 80,0g de O2(g), na
experiência III realizada em um recipiente aberto, está de
acordo com a Lei da Conservação de Massa, de Lavoisier
juliaoliveirac- Jedi

- Mensagens : 456
Data de inscrição : 20/03/2015
Idade : 26
Localização : Aracaju, Sergipe, Brasil
 Re: uefs ba
Re: uefs ba
a) 92 ---- 100%
28 ---- x
x = 30,4%
76 ----- 100%
28 ----- y
y = 36,8%
Falsa.
b) 28 -------- 80
2 --------- z
z = 5,7
2 gramas de nitrogênio para 5,7 gramas de oxigênio.
Falsa.
c) A composição centesimal será sempre a mesma segundo a lei de Proust.
Falsa.
d) 48/16 = 3
64/16 = 4
80/16 = 5
3:4:5
Verdadeira.
e) Não, pois o recipiente está aberto e não haverá conservação das massas, já que os produtos vão ser perdidos para o ambiente.
Falsa.
A alternativa E é muito boba. Questão meio ruim por causa dela.
28 ---- x
x = 30,4%
76 ----- 100%
28 ----- y
y = 36,8%
Falsa.
b) 28 -------- 80
2 --------- z
z = 5,7
2 gramas de nitrogênio para 5,7 gramas de oxigênio.
Falsa.
c) A composição centesimal será sempre a mesma segundo a lei de Proust.
Falsa.
d) 48/16 = 3
64/16 = 4
80/16 = 5
3:4:5
Verdadeira.
e) Não, pois o recipiente está aberto e não haverá conservação das massas, já que os produtos vão ser perdidos para o ambiente.
Falsa.
A alternativa E é muito boba. Questão meio ruim por causa dela.
 Re: uefs ba
Re: uefs ba
obrigada!!! errei na verifiçaão da relacao das massas de oxigenioChristian M. Martins escreveu:a) 92 ---- 100%
28 ---- x
x = 30,4%
76 ----- 100%
28 ----- y
y = 36,8%
Falsa.
b) 28 -------- 80
2 --------- z
z = 5,7
2 gramas de nitrogênio para 5,7 gramas de oxigênio.
Falsa.
c) A composição centesimal será sempre a mesma segundo a lei de Proust.
Falsa.
d) 48/16 = 3
64/16 = 4
80/16 = 5
3:4:5
Verdadeira.
e) Não, pois o recipiente está aberto e não haverá conservação das massas, já que os produtos vão ser perdidos para o ambiente.
Falsa.
A alternativa E é muito boba. Questão meio ruim por causa dela.

juliaoliveirac- Jedi

- Mensagens : 456
Data de inscrição : 20/03/2015
Idade : 26
Localização : Aracaju, Sergipe, Brasil
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













