Termoquímica (calor de formação)
2 participantes
Página 1 de 1
 Termoquímica (calor de formação)
Termoquímica (calor de formação)
Determine o calor de formação do acetileno gasoso (C2H2), a partir dos dados a seguir:
Entalpias de ligação:
H-H: 400 KJ/mol
C-H: 320 KJ/mol
C≡C: 800 KJ/mol
Entalpia de formação:
C(ց): 700KJ/mol
Entalpias de ligação:
H-H: 400 KJ/mol
C-H: 320 KJ/mol
C≡C: 800 KJ/mol
Entalpia de formação:
C(ց): 700KJ/mol
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Re: Termoquímica (calor de formação)
Re: Termoquímica (calor de formação)
2C + H -- H ---> 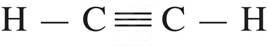
quebra de ligações: absorção de energia (+)
formação de ligações: liberação de energia (-)
∆H = 400 +2.700 - 800 -2.320 --> ∆H = +360 kJ
tem o gabarito? acho que é isso.
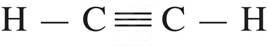
quebra de ligações: absorção de energia (+)
formação de ligações: liberação de energia (-)
∆H = 400 +2.700 - 800 -2.320 --> ∆H = +360 kJ
tem o gabarito? acho que é isso.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Termoquímica (calor de formação)
Re: Termoquímica (calor de formação)
É isso mesmo, Thálisson C. Sempre fiz a variação de entalpia como a soma dos H's dos produtos subtraída dos dos reagentes. Talvez por isso tenha errado essa questão (e outras).
Sempre terei que fazer a análise quanto à quebra ou à formação de ligações?
Sempre terei que fazer a análise quanto à quebra ou à formação de ligações?
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Re: Termoquímica (calor de formação)
Re: Termoquímica (calor de formação)
mas é isso mesmo, variação é final menos inicial.
me refiro aos sinais quanto a energia necessária para quebra ou formação delas, mas a fórmula não muda,
me refiro aos sinais quanto a energia necessária para quebra ou formação delas, mas a fórmula não muda,
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Re: Termoquímica (calor de formação)
Re: Termoquímica (calor de formação)
Entendi. Valeu! 
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Tópicos semelhantes
Tópicos semelhantes» TERMOQUÍMICA/Liberação de calor na formação da agua
» (IME - Discursiva) - Calor de Formação.
» Formação de Calor de NaOH + H2O
» Termoquímica: Calor produzido
» Termoquímica calor da reação de esterificação
» (IME - Discursiva) - Calor de Formação.
» Formação de Calor de NaOH + H2O
» Termoquímica: Calor produzido
» Termoquímica calor da reação de esterificação
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












