sais
2 participantes
Página 1 de 1
 sais
sais
galera n entendi comomontar essas equações e porque
resp a
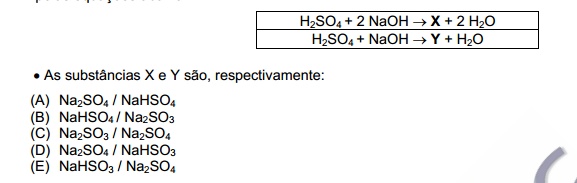
-[size=13.3333](UERJ) Um caminhão transportando ácido sulfúrico capotou, derramando o ácido na estrada. O ácido foi totalmente neutralizado por uma solução aquosa de hidróxido de sódio. Essa neutralização pode ser corretamente representada pelas equações abaixo.[/size]
resp a
-[size=13.3333](UERJ) Um caminhão transportando ácido sulfúrico capotou, derramando o ácido na estrada. O ácido foi totalmente neutralizado por uma solução aquosa de hidróxido de sódio. Essa neutralização pode ser corretamente representada pelas equações abaixo.[/size]


powermetal- Jedi

- Mensagens : 327
Data de inscrição : 12/09/2012
Idade : 32
Localização : minas
 Re: sais
Re: sais
H2SO4 + NaOH -> NaH(SO4) + H2O
-Toda reação de neutralização gera água.
•Temos que balancear a reação acima:
H2SO4 + 2 NaOH -> Na2(SO4) + 2 H2O
•Acima temos os compostos gerados.
-Toda reação de neutralização gera água.
•Temos que balancear a reação acima:
H2SO4 + 2 NaOH -> Na2(SO4) + 2 H2O
•Acima temos os compostos gerados.

mmsilva- Recebeu o sabre de luz

- Mensagens : 122
Data de inscrição : 24/08/2012
Idade : 28
Localização : RJ
 Re: sais
Re: sais
mmsilva escreveu:H2SO4 + NaOH -> NaH(SO4) + H2O
-Toda reação de neutralização gera água.
•Temos que balancear a reação acima:
H2SO4 + 2 NaOH -> Na2(SO4) + 2 H2O
•Acima temos os compostos gerados.
n entendi o seguinte : a euquação que gera NaHSO4 é uma neutralização parcial. Mas a questão fala que o acido foi totalmente neutralizado .. Isso n é uma contradição.??
as duas equaçãoes nãop deveriam ser de neutralização total??

powermetal- Jedi

- Mensagens : 327
Data de inscrição : 12/09/2012
Idade : 32
Localização : minas
 Re: sais
Re: sais
Ah sim!Entendi sua dúvida,acredito que essa reação aconteça em duas etapas que estão representadas nas equações acima,sendo a ultima a equação final.Entretanto,a opinião de alguém com mais conhecimento é bem-vinda.

mmsilva- Recebeu o sabre de luz

- Mensagens : 122
Data de inscrição : 24/08/2012
Idade : 28
Localização : RJ
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












