Modelo atômico de Niels Bohr - dúvida teórica
3 participantes
Página 1 de 1
 Modelo atômico de Niels Bohr - dúvida teórica
Modelo atômico de Niels Bohr - dúvida teórica
Minha dúvida é acerca da explicação que o modelo de Niels Bohr dar para o espectro de linhas ou espectro atômico gerado a partir da decomposição da luz emitida por uma lâmpada de gás (tubos de raios catódicos) contendo um gás específico.
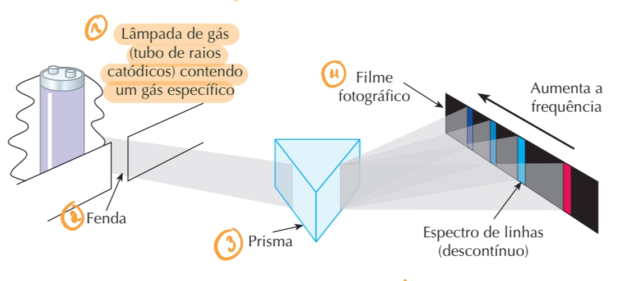
Seguindo os postulados de Niels Bohr e aplicando no funcionamento da lâmpada de gás (tubo de raio catódico), os elétrons são excitados (absorvem energia) através da descarga elétrica, passando de um nível pra outro de maior energia, quando voltam para as suas camadas iniciais, devem liberar energia na forma de onda eletromagnética (no caso a luz).
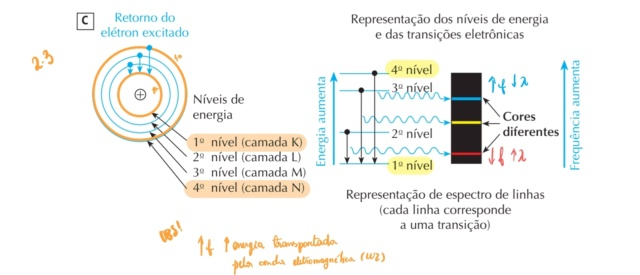
OBS: COMPARANDO APENAS OS ELÉTRONS EXCITADOS QUE ESTAVAM RESPECTIVAMENTE NO 4º NÍVEL E NO 2º NÍVEL
O elétron excitado que estava no 4º nível, quando volta para o seu estado inicial, que nesse caso é a 1º nível, terá que liberar uma quantidade de energia superior a energia que o elétron excitado que estava no 2º nível teria para voltar para o mesmo nível.
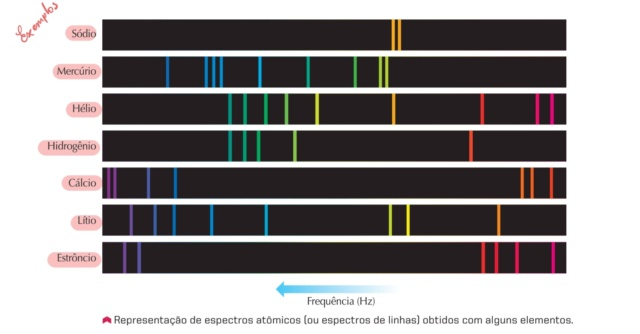
Analisando o espectro atÔmico ou de linhas dado no exemplo, poderia afirmar: ????????
1-a onda eletromagnética liberada pelo primeiro elétron terá maior energia, maior frequência e menor comprimento de onda, esta poderia ser a cor azul ?
2-a onda eletromagnética liberada pelo segundo elétron terá menor energia, menor frequência e maior comprimento de onda, esta poderia ser a cor vermelha ?
Estou um pouco confusa, mas meu livro comenta que: o que irá determinar a cor emitida pela onda eletromagnética do tipo visível, será a diferença de energia envolvida na transição de elétrons entre os níveis e do elemento químico utilizado dentro da lâmpada de gás.



Seguindo os postulados de Niels Bohr e aplicando no funcionamento da lâmpada de gás (tubo de raio catódico), os elétrons são excitados (absorvem energia) através da descarga elétrica, passando de um nível pra outro de maior energia, quando voltam para as suas camadas iniciais, devem liberar energia na forma de onda eletromagnética (no caso a luz).

OBS: COMPARANDO APENAS OS ELÉTRONS EXCITADOS QUE ESTAVAM RESPECTIVAMENTE NO 4º NÍVEL E NO 2º NÍVEL
O elétron excitado que estava no 4º nível, quando volta para o seu estado inicial, que nesse caso é a 1º nível, terá que liberar uma quantidade de energia superior a energia que o elétron excitado que estava no 2º nível teria para voltar para o mesmo nível.
Analisando o espectro atÔmico ou de linhas dado no exemplo, poderia afirmar: ????????
1-a onda eletromagnética liberada pelo primeiro elétron terá maior energia, maior frequência e menor comprimento de onda, esta poderia ser a cor azul ?
2-a onda eletromagnética liberada pelo segundo elétron terá menor energia, menor frequência e maior comprimento de onda, esta poderia ser a cor vermelha ?
Estou um pouco confusa, mas meu livro comenta que: o que irá determinar a cor emitida pela onda eletromagnética do tipo visível, será a diferença de energia envolvida na transição de elétrons entre os níveis e do elemento químico utilizado dentro da lâmpada de gás.

 Re: Modelo atômico de Niels Bohr - dúvida teórica
Re: Modelo atômico de Niels Bohr - dúvida teórica
@Jigsaw oii, desculpa o incômodo, você poderia me ajudar nessa ?
 Re: Modelo atômico de Niels Bohr - dúvida teórica
Re: Modelo atômico de Niels Bohr - dúvida teórica
Foi mal pela demora, eu vou deixar a minha contribuição , caso alguém discorde favor se manifestar:inguz escreveu:@Jigsaw oii, desculpa o incômodo, você poderia me ajudar nessa ?
O elétron excitado que estava no 4º nível, quando volta para o seu estado inicial, que nesse caso é a 1º nível, terá que liberar uma quantidade de energia superior a energia que o elétron excitado que estava no 2º nível teria para voltar para o mesmo nível.
Analisando o espectro atÔmico ou de linhas dado no exemplo, poderia afirmar: ????????
1-a onda eletromagnética liberada pelo primeiro elétron terá maior energia, maior frequência e menor comprimento de onda, esta poderia ser a cor azul ?
Utilizando alguns dados que encontrei no livro do ATKINS vamos tentar calcular comprimento de onda para a cor azul:
[latex]\lambda =\frac{c}{v}=\frac{2,998\times10-8m.s-1}{6,4\times10-14s-1}=4,7\times10-7 m[/latex]
λ = 470 nm
Para calcular a Energia de transição utilize o metodo indicado nesse vídeo:
https://pt.khanacademy.org/science/physics/quantum-physics/atoms-and-electrons/v/bohr-model-energy-levels
2-a onda eletromagnética liberada pelo segundo elétron terá menor energia, menor frequência e maior comprimento de onda, esta poderia ser a cor vermelha ?
Utilizando alguns dados que encontrei no livro do ATKINS vamos tentar calcular comprimento de onda para a cor vermelha:
[latex]\lambda =\frac{c}{v}=\frac{2,998\times10-8m.s-1}{4,3\times10-14s-1}=7\times10-7 m[/latex]
λ = 700 nm
Para calcular a Energia de transição utilize o metodo indicado nesse vídeo:
https://pt.khanacademy.org/science/physics/quantum-physics/atoms-and-electrons/v/bohr-model-energy-levels
Estou um pouco confusa, mas meu livro comenta que: o que irá determinar a cor emitida pela onda eletromagnética do tipo visível, será a diferença de energia envolvida na transição de elétrons entre os níveis e do elemento químico utilizado dentro da lâmpada de gás.
Pelo que entendi se voce tem a Energia, h e c, pode-se determinar o comprimento de onde e, por consequência, a cor emitida pelo elétron (Formula abaixo):





Última edição por Jigsaw em Qui 02 maio 2024, 21:29, editado 1 vez(es) (Motivo da edição : readequação do texto da mensagem)

Jigsaw- Monitor

- Mensagens : 766
Data de inscrição : 26/12/2020
Localização : São Paulo/SP
 Re: Modelo atômico de Niels Bohr - dúvida teórica
Re: Modelo atômico de Niels Bohr - dúvida teórica
Vi que já foi respondida a sua dúvida. Mas também deixarei uma contribuição.
**Leve contextualizada**
O que define bem o modelo de Bohr é a compreensão de que os elétrons estão dispostos em camadas com energias DEFINIDAS. Logo, ao absorverem uma determinada quantidade de energia, eles pulam de nível de energia mais interno para um mais externo.
Ao chegarem ao nível mais externo, eles soltam esta energia absorvida em forma de onda eletromagnética. Como as energias dos níveis são DEFINIDAS, alguns saltos liberam ondas que que se encontram no espectro do visível (outras tantas e tantas se encontram no infravermelho ou ultravioleta).
Quanto maior o salto, maior terá sido a energia quantificada absorvida, e maior será a energia quantificada liberada pelo elétron em seu caminho de volta. Portanto, se um elétron vai do 1 nível de energia ao 4; e outro do 1 ao 2, então qual liberará maior energia eletromagnética? O elétron que vai do 1 ao 4 nível.
Agora lembremos que, quanto maior a energia, a frequência de uma onda eletromagnética, menor será seu comprimento de onda.
Então, teoricamente, o primeiro elétron terá maior energia, maior frequência e provavelmente a cor azul (pequeno comprimento de onda).
O segundo elétron terá menor energia, menor frequência e provavelmente a cor vermelha (grande comprimento de onda).

**Leve contextualizada**
O que define bem o modelo de Bohr é a compreensão de que os elétrons estão dispostos em camadas com energias DEFINIDAS. Logo, ao absorverem uma determinada quantidade de energia, eles pulam de nível de energia mais interno para um mais externo.
Ao chegarem ao nível mais externo, eles soltam esta energia absorvida em forma de onda eletromagnética. Como as energias dos níveis são DEFINIDAS, alguns saltos liberam ondas que que se encontram no espectro do visível (outras tantas e tantas se encontram no infravermelho ou ultravioleta).
Quanto maior o salto, maior terá sido a energia quantificada absorvida, e maior será a energia quantificada liberada pelo elétron em seu caminho de volta. Portanto, se um elétron vai do 1 nível de energia ao 4; e outro do 1 ao 2, então qual liberará maior energia eletromagnética? O elétron que vai do 1 ao 4 nível.
Agora lembremos que, quanto maior a energia, a frequência de uma onda eletromagnética, menor será seu comprimento de onda.
Então, teoricamente, o primeiro elétron terá maior energia, maior frequência e provavelmente a cor azul (pequeno comprimento de onda).
O segundo elétron terá menor energia, menor frequência e provavelmente a cor vermelha (grande comprimento de onda).


miojors- Iniciante
- Mensagens : 3
Data de inscrição : 09/12/2022
Idade : 24
Localização : Pernambuco, Brasil
 Tópicos semelhantes
Tópicos semelhantes» Modelo atômico de Niels Bohr
» Modelo atômico de Ernest Rutherford - Dúvida teórica
» Modelo atômico de Ernest Rutherford - Dúvida teórica
» (UFMG–2009) A) No modelo de Niels Bohr para o
» Modelo atômico de Bohr.
» Modelo atômico de Ernest Rutherford - Dúvida teórica
» Modelo atômico de Ernest Rutherford - Dúvida teórica
» (UFMG–2009) A) No modelo de Niels Bohr para o
» Modelo atômico de Bohr.
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













