ligações químicas
3 participantes
Página 1 de 1
 ligações químicas
ligações químicas
(PUC Rio) No composto P2O5, nas ligações P—O,
o número de ligações covalentes coordenadas é
A) 1.
B) 2.
C) 3.
D) 4.
E) 5.
gab letra b
duvida: minha maior duvida está na forma como a molécula foi apresentada: P2O5, até onde eu sei ao apresentar uma molécula de ligações químicas ela tem que vir naquela formula unitária, onde para obtê-la cruzamos a quantidade de elétrons que vão ser ganhos e perdidos
nesse caso ficaria P+5(perderia 5 elétrons ou ganhariam 5 elétrons?) O-2(oxigênio necessitaria de ganhar 2 elétrons para se estabilizar com 8 elétrons )
não entendi esse 5 do fosfato se alguém puder ajudar agradeço
o número de ligações covalentes coordenadas é
A) 1.
B) 2.
C) 3.
D) 4.
E) 5.
gab letra b
duvida: minha maior duvida está na forma como a molécula foi apresentada: P2O5, até onde eu sei ao apresentar uma molécula de ligações químicas ela tem que vir naquela formula unitária, onde para obtê-la cruzamos a quantidade de elétrons que vão ser ganhos e perdidos
nesse caso ficaria P+5(perderia 5 elétrons ou ganhariam 5 elétrons?) O-2(oxigênio necessitaria de ganhar 2 elétrons para se estabilizar com 8 elétrons )
não entendi esse 5 do fosfato se alguém puder ajudar agradeço

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
 Re: ligações químicas
Re: ligações químicas
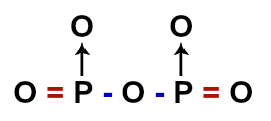
A ligação é covalente, ninguém perde ou ganha e sim há compartilhamento de 5 elétrons.
O "+" ou "-" indica para qual átomo os elétrons tendem mais ( no caso, o oxigênio é mais eletronegativo que o fósforo, atraindo um pouco mais ).

Reverse.- Jedi

- Mensagens : 341
Data de inscrição : 05/06/2021
nathanvasoncelos958 gosta desta mensagem
 Re: ligações químicas
Re: ligações químicas
perdoe minha ignorância reverse acabei escrevendo ganhar ou perder, mas quis dizer compartilhar elétrons das camadas de valência
mas porque fica P2O5?
se o ''P'' precisa ganhar 3 elétrons para estabilidade
o ''Oxigênio'' precisa de ganhar 2 elétrons para estabilidade
pela formula unitária deveria ser P2O3
qual meu erro?
um exemplo:
CH4 tem essa formula molecular porque:
carbono precisa ganhar 4
hidrogênio ganhar 1
na determinação da formula unitária fica: CH4
mas porque fica P2O5?
se o ''P'' precisa ganhar 3 elétrons para estabilidade
o ''Oxigênio'' precisa de ganhar 2 elétrons para estabilidade
pela formula unitária deveria ser P2O3
qual meu erro?
um exemplo:
CH4 tem essa formula molecular porque:
carbono precisa ganhar 4
hidrogênio ganhar 1
na determinação da formula unitária fica: CH4

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
 Re: ligações químicas
Re: ligações químicas
Essa proposição funciona apenas em ligações em que o propósito é alguém perder e outro alguém ganhar. Veja:
[latex]Cr^{3+} + O^{2-} \mapsto Cr2O3[/latex]
No entanto, quando existem ligações covalentes, devemos recorrer a outras formas de denominar a fórmula molecular, pois podem existir elétrons sobrando que podem fazer mais ligações ( geralmente dativas ). o composto trióxido de difósforo que você propôs de fato existe, mas da forma como se escreve ( P2O3 ) seria possível apenas se o fósforo tendesse a ceder elétrons, porém o número que deve ficar em cima do fósforo é 3-, e não 3+, indicando que ele quer ganhar elétrons.
fazendo por essa lógica teríamos:
[latex]P^{3-} + O^{2-} \mapsto P2O3-[/latex]
(Absurdo)
Acho que seu erro foi considerar que o número acima do fósforo (3-) venha a ficar positivo também, mas tenha muito cuidado ao montar compostos apenas cruzando os números acima deles sem analisar o tipo de ligação e a eletronegatividade dos átomos.

Reverse.- Jedi

- Mensagens : 341
Data de inscrição : 05/06/2021
nathanvasoncelos958 gosta desta mensagem
 Re: ligações químicas
Re: ligações químicas
obrigado reverse, não sabia que essa regra não valia para todos
ultima duvida :
no caso do metano(CH4) mesmo sendo ligação covalente, ele obedeceu essa regra ou como chegaria a sua formula ?'
ultima duvida :
no caso do metano(CH4) mesmo sendo ligação covalente, ele obedeceu essa regra ou como chegaria a sua formula ?'

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
 Re: ligações químicas
Re: ligações químicas
O carbono quer fazer 4 ligações, o hidrogênio 1, então é só ligar ambos até satisfazer suas necessidades por elétrons, e coincidentemente isso ocorre formando o metano, coincidindo também com a regra.
A questão realmente é só prestar atenção na hora de montar o composto, ainda mais quando são vários átomos de uma vez com eletronegatividades distintas. Se restarem dúvidas nessa hora, alopre e tente fazer com a fórmula de lewis.

Reverse.- Jedi

- Mensagens : 341
Data de inscrição : 05/06/2021
 Re: ligações químicas
Re: ligações químicas
reverse agradeço  novamente
novamente
e venho com a ultima duvida para parar de encher seu saco kkkk
mas o que a eletronegatividade interfere ao montar a formula estrutural da ligação covalente?
até lembrava ela só interfere puxando os pares de elétrons para perto do átomo mais eletronegativo não é ?
agradeço de novo reverse daria um abraço em você kkkk, se não morasse tão longe '-'
 novamente
novamente e venho com a ultima duvida para parar de encher seu saco kkkk
mas o que a eletronegatividade interfere ao montar a formula estrutural da ligação covalente?
até lembrava ela só interfere puxando os pares de elétrons para perto do átomo mais eletronegativo não é ?
agradeço de novo reverse daria um abraço em você kkkk, se não morasse tão longe '-'

nathanvasoncelos958- Jedi

- Mensagens : 252
Data de inscrição : 30/04/2021
Idade : 23
 Re: ligações químicas
Re: ligações químicas
No caso eu falei de eletronegatividade de uma forma geral, pois existem também os compostos iônicos ( compostos que podem ter tanto ligações iônicas quanto covalentes ), e dependendo da necessidade de ganhar, perder ou compartilhar elétrons você pode se embananar para formar uma molécula com diversos átomos, acabando por confundir qual ligação ocorre, mas acho extremamente difícil acontecer.
Pode encher meu saco a vontade kkkk.

Reverse.- Jedi

- Mensagens : 341
Data de inscrição : 05/06/2021
nathanvasoncelos958 gosta desta mensagem
 Re: ligações químicas
Re: ligações químicas
duas duvidas, primeiro, como vc chegou nessa formula? eu considerei que por estarem em menor quantidade os P deveriam estar no meioReverse. escreveu:A ligação é covalente, ninguém perde ou ganha e sim há compartilhamento de 5 elétrons.O "+" ou "-" indica para qual átomo os elétrons tendem mais ( no caso, o oxigênio é mais eletronegativo que o fósforo, atraindo um pouco mais ).
segunda, se a ligação do Oxigênio do meio com o P é dupla, logo o O e o P estariam estáveis, não seria a partir dai 4 ligações dativas?
guilhermendes- Iniciante
- Mensagens : 22
Data de inscrição : 02/03/2022
 Re: ligações químicas
Re: ligações químicas
guilhermendes escreveu:duas duvidas, primeiro, como vc chegou nessa formula? eu considerei que por estarem em menor quantidade os P deveriam estar no meio
Simplesmente fui testando até chegar na fórmula, a experiência das questões ajudou. Inclusive, me mostre como você pensou essa representação.
"segunda, se a ligação do Oxigênio do meio com o P é dupla, logo o O e o P estariam estáveis, não seria a partir dai 4 ligações dativas?"
A ligação do oxigênio do meio com ambos os fósforos é simples, estabilizando-o. Os fósforos ainda se ligam, por meio de uma dupla, com mais 2 oxigênios, o que estabiliza ambos os elementos simultaneamente. Sobram 2 pares de elétrons livres, um em cada fósforo, que se ligam com mais 2 oxigênios por ligação dativa.

Reverse.- Jedi

- Mensagens : 341
Data de inscrição : 05/06/2021
 Tópicos semelhantes
Tópicos semelhantes» Ligações químicas - Estrutura e ligações do NO2
» ligações químicas
» Ligaçoes quimicas
» Ligações químicas
» Ligações químicas
» ligações químicas
» Ligaçoes quimicas
» Ligações químicas
» Ligações químicas
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












