Raio ionico
2 participantes
Página 1 de 1
 Raio ionico
Raio ionico
– Considere os íons/átomos seguintes: O-2, F–, Ne, Na+ e
Mg2+. Sobre as propriedades periódicas dos mesmos, assinale
o que for correto.
Dados: O(Z= ; F(Z=9); Ne(Z=10); Na(Z=11); Mg(Z=12)
; F(Z=9); Ne(Z=10); Na(Z=11); Mg(Z=12)
01) Considerando apenas os átomos destes elementos
químicos, a ordem crescente dos raios é a seguinte:
Na < Mg < O
ionização é o Mg2+.
04) O Ne apresenta uma energia de ionização menor
que o F– e o O-2
08) O íon O-2 é que apresenta o maior raio iônico.
16) O íon Mg2+ apresenta maior energia de ionização
que o Na+.
r= 08 e 16
Eu entendo que O-2 apresentaria um raio maior que o O. Mas como eu sei que o O-2 é maior que o Na+, sendo que o Na ainda esta mais proximo do canto esquerdo da tabela (que tem a ver com maior raio)? Ser anion ou cation deve ~pesar mais~ que a posicao na tabela?
Mg2+. Sobre as propriedades periódicas dos mesmos, assinale
o que for correto.
Dados: O(Z=
01) Considerando apenas os átomos destes elementos
químicos, a ordem crescente dos raios é a seguinte:
Na < Mg < O
ionização é o Mg2+.
04) O Ne apresenta uma energia de ionização menor
que o F– e o O-2
08) O íon O-2 é que apresenta o maior raio iônico.
16) O íon Mg2+ apresenta maior energia de ionização
que o Na+.
r= 08 e 16
Eu entendo que O-2 apresentaria um raio maior que o O. Mas como eu sei que o O-2 é maior que o Na+, sendo que o Na ainda esta mais proximo do canto esquerdo da tabela (que tem a ver com maior raio)? Ser anion ou cation deve ~pesar mais~ que a posicao na tabela?

waydzik- Jedi

- Mensagens : 401
Data de inscrição : 25/09/2017
Idade : 27
Localização : Curitiba
 Re: Raio ionico
Re: Raio ionico
Brother, é só aplicar a Lei de Coulomb -> F=K.Q+.q-/R²
Quanto mais intensa essa atração Próton-Elétron, menor é o raio iônico.
Quanto menos intensa essa atração Próton-Elétron, maior é o raio iônico
Nesse caso, sua analise deve partir da quantidade de prótons no núcleo, por exemplo íons em questão possuem o mesmo número de elétrons, portanto, possuem a mesma configuração eletrônica que é de um gás nobre. No entanto, o que se diferencia entre eles, é a proporção de prótons, veja que o O(z= tem a menor quantidade de tais partículas no núcleo, logo, podemos concluir que a atração eletrosfera-núcleo é menos intensa, então o raio de atuação acaba de sendo maior.
tem a menor quantidade de tais partículas no núcleo, logo, podemos concluir que a atração eletrosfera-núcleo é menos intensa, então o raio de atuação acaba de sendo maior.
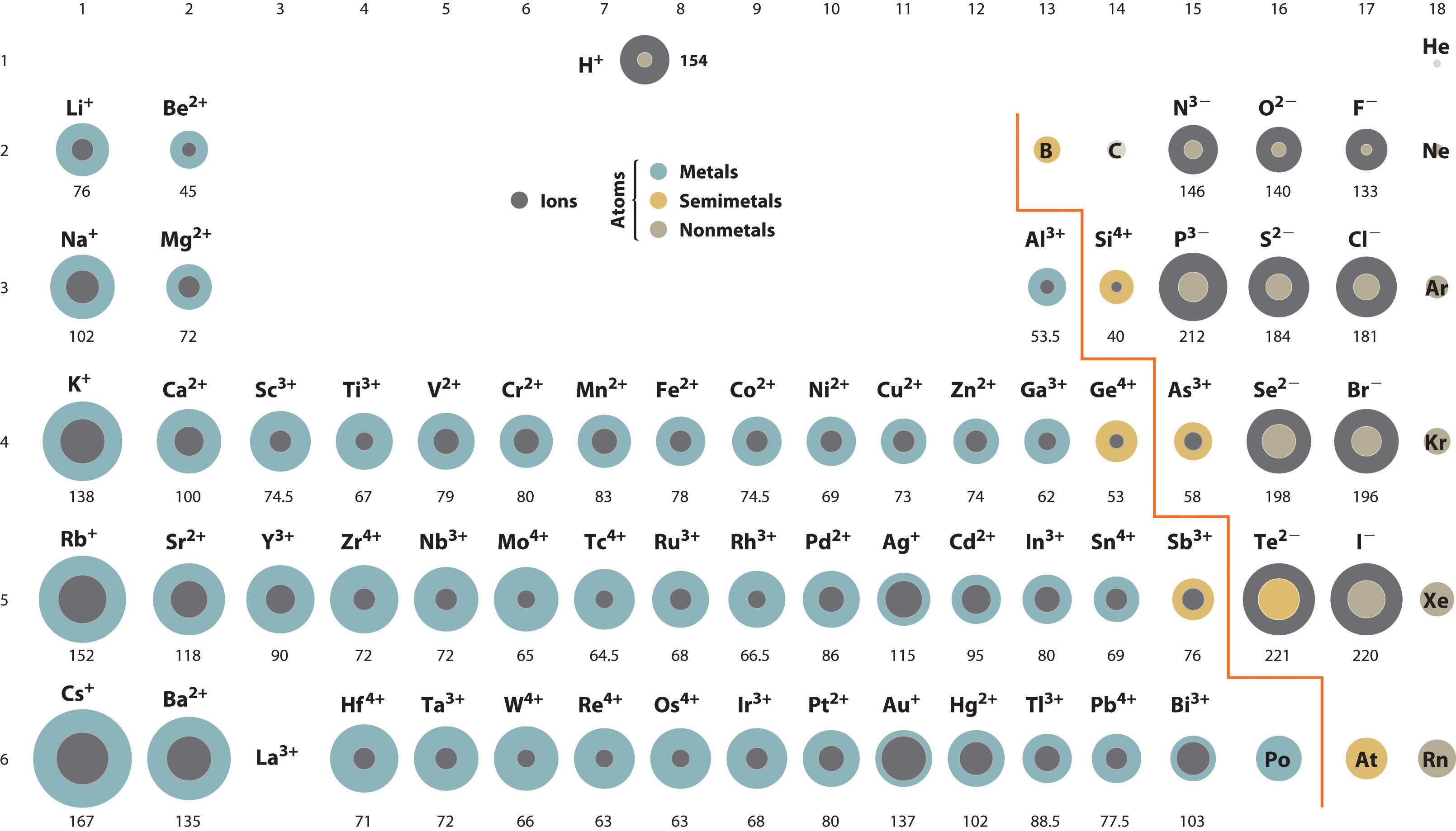
Se não acredita em min, analise. Obviamente, não podemos concluir que uma especie catiônica tem raio iônico menor que uma espécie anódica. Veja o RCs+>RO-2 ; porém, a analise muda pois você tem espécies distintas para comparação.
Daí, podemos fazer uma segunda analise, quanto menor o raio maior será a energia de ionização, que por definição seria a minima energia que se retirar um elétron em orbita de uma especie química gasosa, "levando-o ao infinito" - isto é ionizar. Desse modo, você consegue responder o restante das alternativas de boa.
Quanto mais intensa essa atração Próton-Elétron, menor é o raio iônico.
Quanto menos intensa essa atração Próton-Elétron, maior é o raio iônico
Nesse caso, sua analise deve partir da quantidade de prótons no núcleo, por exemplo íons em questão possuem o mesmo número de elétrons, portanto, possuem a mesma configuração eletrônica que é de um gás nobre. No entanto, o que se diferencia entre eles, é a proporção de prótons, veja que o O(z=

Se não acredita em min, analise. Obviamente, não podemos concluir que uma especie catiônica tem raio iônico menor que uma espécie anódica. Veja o RCs+>RO-2 ; porém, a analise muda pois você tem espécies distintas para comparação.
Daí, podemos fazer uma segunda analise, quanto menor o raio maior será a energia de ionização, que por definição seria a minima energia que se retirar um elétron em orbita de uma especie química gasosa, "levando-o ao infinito" - isto é ionizar. Desse modo, você consegue responder o restante das alternativas de boa.

Unßer- Padawan

- Mensagens : 82
Data de inscrição : 09/02/2017
Idade : 26
Localização : Juazeiro,Bahia
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












