Subnível Mais Energético
2 participantes
Página 1 de 1
 Subnível Mais Energético
Subnível Mais Energético
UFCE
Os átomos E,G,J e M apresentam seus respectivos subníveis mais energéticos, que são:

Com relação a estes dados assinale a alternativa correta e justifique porque as demais são falsas:
a) G e M formam composto iônico, cuja fórmula é:
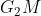
b) O íon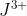 possui como subnível mais energético o 6s².
possui como subnível mais energético o 6s².
c) E e J formam composto covalente de fórmula química:
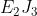
d) O elétron do átomo E, com os números quânticos:

pertence ao subnível 4s.
Gabarito:
Letra "d"
Os átomos E,G,J e M apresentam seus respectivos subníveis mais energéticos, que são:

Com relação a estes dados assinale a alternativa correta e justifique porque as demais são falsas:
a) G e M formam composto iônico, cuja fórmula é:
b) O íon
c) E e J formam composto covalente de fórmula química:
d) O elétron do átomo E, com os números quânticos:

pertence ao subnível 4s.
Gabarito:
Letra "d"

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: Subnível Mais Energético
Re: Subnível Mais Energético

a) Quando se trata de ligações, acredito que as camadas de valência devem ser consideradas.
No caso do G o nível mais afastado do centro é o 3. Percebe-se que tem 6 elétrons nesse nível e para se estabilizar ele precisa receber mais 2. Já o M tem como camada de valência o nível 4 que contêm 2 elétrons. Portanto, o M precisa "perder" esses 2 elétrons para se estabilizar.
Então, a fórmula do composto iônico será GM.
b) A distribuição energética do J é:
1s(2) , 2s(2) , ... , 6s(2) , 4f(3).
Esse cátion de J perde 3 elétrons da camada de valência e, não, do subnível mais energético, como foi considerado.
Portanto, o subnível mais energético desse cátion será o 4f(1).
c) Similar a a).
d) n=4 ---- nível=4
l=0 ---- subnível s
m=-1/2:
teria que ver a convenção adotada, mas se -1/2 corresponde ao primeiro elétron naquela regra de Hund, então só tem um elétrons nesse subnível, chegando a 4s(1).
Diogo- Jedi

- Mensagens : 261
Data de inscrição : 12/03/2010
Idade : 30
Localização : Paraná
 Re: Subnível Mais Energético
Re: Subnível Mais Energético
Oi Diogo, no caso do item "b".
b) A distribuição energética do J é:
1s(2) , 2s(2) , ... , 6s(2) , 4f(3).
Esse cátion de J perde 3 elétrons da camada de valência e, não, do subnível mais energético, como foi considerado.
No caso após ele perder os três elétrons o subnível mais energético seria o:
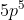
?
b) A distribuição energética do J é:
1s(2) , 2s(2) , ... , 6s(2) , 4f(3).
Esse cátion de J perde 3 elétrons da camada de valência e, não, do subnível mais energético, como foi considerado.
No caso após ele perder os três elétrons o subnível mais energético seria o:
?

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: Subnível Mais Energético
Re: Subnível Mais Energético
É mesmo. Na verdade tem que tirar primeiro os elétrons dos níveis 6 e 5. Por outro lado o subnível mais energético, pelo o que eu percebi, continuará sendo o 4f(2). Não seria isso?
Diogo- Jedi

- Mensagens : 261
Data de inscrição : 12/03/2010
Idade : 30
Localização : Paraná
 Re: Subnível Mais Energético
Re: Subnível Mais Energético
Diogo escreveu:É mesmo. Na verdade tem que tirar primeiro os elétrons dos níveis 6 e 5. Por outro lado o subnível mais energético, pelo o que eu percebi, continuará sendo o 4f(2). Não seria isso?
Não entendi bem porque seria o 4f².
Você tiro 2 elétrons dos 6s² e um do 4f³ ?

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: Subnível Mais Energético
Re: Subnível Mais Energético
foi mal, continuará sendo o 4f(3)!
Tiirei 2 e do 6s(2) e mais 1 do 5p(6). A configuração eletrônica, seguindo os subníveis mais energéticos, ficará agora:
1s(2) , 2s(2) , ... , 5p(5) , 4f(3)
Acredito que seja isso.
Tiirei 2 e do 6s(2) e mais 1 do 5p(6). A configuração eletrônica, seguindo os subníveis mais energéticos, ficará agora:
1s(2) , 2s(2) , ... , 5p(5) , 4f(3)
Acredito que seja isso.
Diogo- Jedi

- Mensagens : 261
Data de inscrição : 12/03/2010
Idade : 30
Localização : Paraná
 Re: Subnível Mais Energético
Re: Subnível Mais Energético
Diogo escreveu:foi mal, continuará sendo o 4f(3)!
Tiirei 2 e do 6s(2) e mais 1 do 5p(6). A configuração eletrônica, seguindo os subníveis mais energéticos, ficará agora:
1s(2) , 2s(2) , ... , 5p(5) , 4f(3)
Acredito que seja isso.
Vlw Diogo !

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Tópicos semelhantes
Tópicos semelhantes» Subnível mais energético
» Subnível mais energético
» Subnível energético
» Energia de um elétron em um subnível energético
» Dúvida--> Elétron mais energético e mais externo--> Dist.Orbitais
» Subnível mais energético
» Subnível energético
» Energia de um elétron em um subnível energético
» Dúvida--> Elétron mais energético e mais externo--> Dist.Orbitais
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












