FUVEST - pH
4 participantes
Página 1 de 1
 FUVEST - pH
FUVEST - pH
Considere 4 frascos, cada um contendo diferentes substâncias, a saber:
Frasco 1: 100 mL de H2O(l)
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de HNO3 de concentração 1,2 mol/L
A cada um desses frascos, adicionaram-se, em experimentos distintos, 100 mL de uma solução aquosa de HCl de concentração 1,0 moI/L. Medindo-se o pH do líquido contido em cada frasco, antes e depois da adição de HC (aq), pôde-se observar aumento do valor do pH somente
a) nas soluções dos frascos 1, 2 e 4.
b) nas soluções dos frascos 1 e 3.
c) nas soluções dos frascos 2 e 4.
d) na solução do frasco 3.
e) na solução do frasco 4.
No frasco 01 e 03, o ph diminui? No 02 e 04, se ambos são ácidos, adicionando HCl, o ph não fica mais baixo ainda? Não entendo como adicionando um ácido a outro ácido, o ph aumenta. :suspect:
Frasco 1: 100 mL de H2O(l)
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de HNO3 de concentração 1,2 mol/L
A cada um desses frascos, adicionaram-se, em experimentos distintos, 100 mL de uma solução aquosa de HCl de concentração 1,0 moI/L. Medindo-se o pH do líquido contido em cada frasco, antes e depois da adição de HC (aq), pôde-se observar aumento do valor do pH somente
a) nas soluções dos frascos 1, 2 e 4.
b) nas soluções dos frascos 1 e 3.
c) nas soluções dos frascos 2 e 4.
d) na solução do frasco 3.
e) na solução do frasco 4.
No frasco 01 e 03, o ph diminui? No 02 e 04, se ambos são ácidos, adicionando HCl, o ph não fica mais baixo ainda? Não entendo como adicionando um ácido a outro ácido, o ph aumenta. :suspect:

fergasfig- Estrela Dourada

- Mensagens : 1052
Data de inscrição : 08/04/2015
Idade : 29
Localização : São Paulo- SP
 Re: FUVEST - pH
Re: FUVEST - pH
No frasco supõe-se ser água pura, com pH=7. Como o HCl é forte, o pH diminuirá. Ácido Acético é ácido fraco e terá a concentração de H+ aumentada, logo o pH também diminui.
No frasco três temos uma base. Observe que as concentrações são as mesmas para o KOH e para o HCl que irá ser adicionado. Haverá, então, uma neutralização. O pH, que era superior a sete, diminuirá.
Agora o frasco 4:
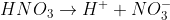
Antes do experimento há uma solução de 100ml com molaridade de 1,2 mol/l. Há, portando, 0,12 mol de Hidrogênio, concorda?
Na solução de HCl há 100ml com molaridade de 1,0 mol/l, o que dá 0,1 mol de Hidrogênio.
Quando as soluções são misturadas, haverá 0,22 mol de Hidrogênio para 0,2L de solução. A concentração molar do hidrogênio será de 0,22mol/0,2L, que é 1,1 mol/l.
A molaridade final será menor que a molaridade inicial, que era de 1,2 mol/l. Como a molaridade diminuiu, o pH aumentou.
Acho que você não considerou que os volumes iriam aumentar também e que a molaridade depende deles (e consequentemente, o pH).
No frasco três temos uma base. Observe que as concentrações são as mesmas para o KOH e para o HCl que irá ser adicionado. Haverá, então, uma neutralização. O pH, que era superior a sete, diminuirá.
Agora o frasco 4:
Antes do experimento há uma solução de 100ml com molaridade de 1,2 mol/l. Há, portando, 0,12 mol de Hidrogênio, concorda?
Na solução de HCl há 100ml com molaridade de 1,0 mol/l, o que dá 0,1 mol de Hidrogênio.
Quando as soluções são misturadas, haverá 0,22 mol de Hidrogênio para 0,2L de solução. A concentração molar do hidrogênio será de 0,22mol/0,2L, que é 1,1 mol/l.
A molaridade final será menor que a molaridade inicial, que era de 1,2 mol/l. Como a molaridade diminuiu, o pH aumentou.
Acho que você não considerou que os volumes iriam aumentar também e que a molaridade depende deles (e consequentemente, o pH).

gabrielnogueira- Recebeu o sabre de luz

- Mensagens : 131
Data de inscrição : 24/07/2014
Idade : 26
Localização : Ceará, Brasil
 Re: FUVEST - pH
Re: FUVEST - pH
Ahhh entendi, Gabriel! Não considerei mesmo, muito obrigada

fergasfig- Estrela Dourada

- Mensagens : 1052
Data de inscrição : 08/04/2015
Idade : 29
Localização : São Paulo- SP
 Re: FUVEST - pH
Re: FUVEST - pH
"Ácido Acético é ácido fraco e terá a concentração de H+ aumentada, logo o pH também diminui."
Porque posso considerar isso? É uma propriedade?
Obrigada.
Porque posso considerar isso? É uma propriedade?
Obrigada.

Sunriseee- Jedi

- Mensagens : 268
Data de inscrição : 20/05/2016
Idade : 28
Localização : SP - Brasil
 Re: FUVEST - pH
Re: FUVEST - pH
É intuitivo, note:
Se eu tenho num recipiente uma solução de volume V, de ácido acético, um ácido fraco (suponha que possua um pH =6) , e misturo nesse recipiente uma solução, tbm de volume V, de ácido clorídrico, um ácido forte (suponha que possua um pH=2). É natural que o pH da mistura, de volume 2V, pertença ao seguinte intervalo: 2< pH <6. Ou seja, a [H+] aumentou, quando comparada a solução de ác. acético puro.
Se eu tenho num recipiente uma solução de volume V, de ácido acético, um ácido fraco (suponha que possua um pH =6) , e misturo nesse recipiente uma solução, tbm de volume V, de ácido clorídrico, um ácido forte (suponha que possua um pH=2). É natural que o pH da mistura, de volume 2V, pertença ao seguinte intervalo: 2< pH <6. Ou seja, a [H+] aumentou, quando comparada a solução de ác. acético puro.
____________________________________________
Cha-la head-cha-la

Vitor Ahcor- Monitor

- Mensagens : 780
Data de inscrição : 21/12/2018
Idade : 24
Localização : Taurdal
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












