estequimetria
4 participantes
Página 1 de 1
 estequimetria
estequimetria
A partir de 1º de janeiro de 2014, começou a valer a obrigatoriedade da presença de airbag, dispositivo para proteger
condutores e passageiros quando ocorre uma colisão, em carros fabricados no Brasil. Trata-se de um sistema composto basicamente por NaN3 e KNO3. Com o impacto, as substâncias são misturadas e reagem para inflar a bolsa, conforme as seguintes equações químicas:
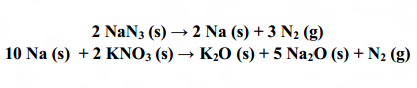 [/img]
[/img]
Considerando que um airbag para um determinado tipo de carro precisa de 98,0 litros de
nitrogênio, a 25ºC, 1,0 atm, qual a massa de NaN3 necessária para produzir esse volume?
Dados: Massas atômicas (u) – N = 14; O = 16; Na = 23; K = 39.
Volume molar (25°C; 1,0 atm) = 24,5 L/mol
gabarito : 162,5 gramas
condutores e passageiros quando ocorre uma colisão, em carros fabricados no Brasil. Trata-se de um sistema composto basicamente por NaN3 e KNO3. Com o impacto, as substâncias são misturadas e reagem para inflar a bolsa, conforme as seguintes equações químicas:
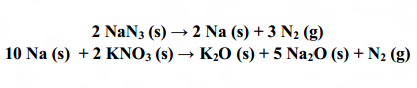 [/img]
[/img]Considerando que um airbag para um determinado tipo de carro precisa de 98,0 litros de
nitrogênio, a 25ºC, 1,0 atm, qual a massa de NaN3 necessária para produzir esse volume?
Dados: Massas atômicas (u) – N = 14; O = 16; Na = 23; K = 39.
Volume molar (25°C; 1,0 atm) = 24,5 L/mol
gabarito : 162,5 gramas

rodocarnot- Jedi

- Mensagens : 250
Data de inscrição : 16/01/2013
Idade : 29
Localização : recife, pernambuco, brasil
 Re: estequimetria
Re: estequimetria
Encontrei um valor diferente; veja se encontra algum erro.
98 L / 24,5 L/mol = 4 mols de N2.
A proporção, segundo a 1ª reação é:
2 mols de NaN3 ------ 3 mols de N2
Fazendo a regra de 3 (se não conseguir enxergar direto) verá que são necessários 2/3 * 4 = 8/3 mols de NaN3, cuja massa molar é 65 g/mol.
65 g/mol * 8/3 mol = 173,33 g
98 L / 24,5 L/mol = 4 mols de N2.
A proporção, segundo a 1ª reação é:
2 mols de NaN3 ------ 3 mols de N2
Fazendo a regra de 3 (se não conseguir enxergar direto) verá que são necessários 2/3 * 4 = 8/3 mols de NaN3, cuja massa molar é 65 g/mol.
65 g/mol * 8/3 mol = 173,33 g

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: estequimetria
Re: estequimetria
Rapaz , fiz assim , mas não bate com o gabarito , acho que essa questão pode ser anulada no vestibular , valeu!!Ashitaka escreveu:Encontrei um valor diferente; veja se encontra algum erro.
98 L / 24,5 L/mol = 4 mols de N2.
A proporção, segundo a 1ª reação é:
2 mols de NaN3 ------ 3 mols de N2
Fazendo a regra de 3 (se não conseguir enxergar direto) verá que são necessários 2/3 * 4 = 8/3 mols de NaN3, cuja massa molar é 65 g/mol.
65 g/mol * 8/3 mol = 173,33 g

rodocarnot- Jedi

- Mensagens : 250
Data de inscrição : 16/01/2013
Idade : 29
Localização : recife, pernambuco, brasil
 Re: estequimetria
Re: estequimetria
multiplicando a primeira equação por 5 e somando com a segunda:
10 NaN3 --> 10 Na + 15 N2
10 Na + 2 KNO3 --> K2O + 5 Na2O + N2
------------------------------------------------------
10 NaN3 + 2KNO3 --> 16 N2 + K2O + 5 Na2O
10 mol 16 mol
x 98l --> x = 61,25 l
24,5 --- 1 mol
61,25 -- x mol ---> x = 2,5 mol de NaN3
m = n.M --> m = 2,5 . 65 --> m = 162,5 g
10 NaN3 --> 10 Na + 15 N2
10 Na + 2 KNO3 --> K2O + 5 Na2O + N2
------------------------------------------------------
10 NaN3 + 2KNO3 --> 16 N2 + K2O + 5 Na2O
10 mol 16 mol
x 98l --> x = 61,25 l
24,5 --- 1 mol
61,25 -- x mol ---> x = 2,5 mol de NaN3
m = n.M --> m = 2,5 . 65 --> m = 162,5 g
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
 Dúvida
Dúvida
Por que multiplicou por 5, mesmo as duas equações já estando balanceada?Thálisson C escreveu:multiplicando a primeira equação por 5 e somando com a segunda:
10 NaN3 --> 10 Na + 15 N2
10 Na + 2 KNO3 --> K2O + 5 Na2O + N2
------------------------------------------------------
10 NaN3 + 2KNO3 --> 16 N2 + K2O + 5 Na2O
10 mol 16 mol
x 98l --> x = 61,25 l
24,5 --- 1 mol
61,25 -- x mol ---> x = 2,5 mol de NaN3
m = n.M --> m = 2,5 . 65 --> m = 162,5 g
Lidilidilidi7000- Iniciante
- Mensagens : 2
Data de inscrição : 30/10/2021
 Re: estequimetria
Re: estequimetria
Lidilidilidi7000 escreveu:Por que multiplicou por 5, mesmo as duas equações já estando balanceada?Thálisson C escreveu:multiplicando a primeira equação por 5 e somando com a segunda:
10 NaN3 --> 10 Na + 15 N2
10 Na + 2 KNO3 --> K2O + 5 Na2O + N2
------------------------------------------------------
10 NaN3 + 2KNO3 --> 16 N2 + K2O + 5 Na2O
10 mol 16 mol
x 98l --> x = 61,25 l
24,5 --- 1 mol
61,25 -- x mol ---> x = 2,5 mol de NaN3
m = n.M --> m = 2,5 . 65 --> m = 162,5 g
Ele multiplicou por 5 para "cancelar" os Na que estavam sozinhos de cada lado da equação, ao somar, e chegar em uma equação global que realmente representa o fenômeno que ocorre.
Na época eu achei essa questão mal escrita (ainda acho que poderia ser mais clara), porque embora ela diga
"Trata-se de um sistema composto basicamente por NaN3 e KNO3. Com o impacto, as substâncias são misturadas e reagem para inflar a bolsa"
acaba fazendo a pergunta de uma forma que faz parecer que a segunda equação pode ser ignorada, já que fala exclusivamente do NaN3. Mas na realidade, ela quer que considere que haverá necessariamente as duas equações acontecendo simultaneamente. Eu não sei se se uma depende da outra necessariamente já que a questão pressupõe uma resolução como o Thálisson fez. Caso a primeira decomposição ocorra e produza N2 sem a necessidade da segunda equação, penso ficar reforçado a questão estar mal escrita.Mas, partindo do pressuposto que as duas devem ocorrer, o sódio será apenas um intermediário formado na primeira reação e totalmente consumido pela segunda, não fazendo parte da global. Por isso, multiplica-se por 5 para cancelar sua presença na reação global.
Somando as equações sem multiplicar por 5, o Na permaneceria:
2 NaN3 + 2KNO3 + 8 Na --> 4 N2 + K2O + 5 Na2O
Veja que considerar o Na presente como se fizesse parte da global acaba alterando os coeficientes e leva à uma resposta também diferente do gabarito.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












