Questão MACKENZIE -PH
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Questão MACKENZIE -PH
Questão MACKENZIE -PH
''Na adição de 100 mL de solução aquosa de ácido clorídrico,que apresenta 0,365 g de HCl,a 400 ml de NaOH 0,075M,o ph da solução resultante é:
(Dados: log 2=0,3)
RESP: 12,6
Tentei de tudo,transformei o volume para litro e depois calculei (M1V1=M2V2) pra achar a molaridade do HCl.Feito isso,montei a reação e descobri que há excesso de 0,225 do ácido em questão.Logo após, dividi 0,225 pelo volume total e não encontrei o valor do pH ,estou completamente errada ou tem algumas coisas certas?? Por favor me ajudem!
Por favor me ajudem!
(Dados: log 2=0,3)
RESP: 12,6
Tentei de tudo,transformei o volume para litro e depois calculei (M1V1=M2V2) pra achar a molaridade do HCl.Feito isso,montei a reação e descobri que há excesso de 0,225 do ácido em questão.Logo após, dividi 0,225 pelo volume total e não encontrei o valor do pH ,estou completamente errada ou tem algumas coisas certas??

fermesquitaa- Iniciante
- Mensagens : 8
Data de inscrição : 24/09/2013
Idade : 30
Localização : São Paulo
 Re: Questão MACKENZIE -PH
Re: Questão MACKENZIE -PH
Dados:
V1 = 0,100 L solução HCl
V2 = 0,400 L solução NaOH
V = V1+V2 = 0,500 L (após a mistura das soluções)
Resolução:
n (HCl) = m/M = (0,365 g)/(36,5 g/mol) = 0,01 mol
n (NaOH) = [NaOH]. V2 = (0,075 mol/L).(0,400 L) = 0,03 mol
Neutralização: (Desconsidere a água produzida na reação)
-------------- HCl(aq) + NaOH(aq) --> NaCl(aq) + H2O(l)
Início: ----- 0,01 mol --- 0,03 mol ------ 0 ----------- 0
Variação: -- -0,01 mol -- -0,01 mol -- +0,01 mol ---- /
Final: ------- 0 --------- 0,02 mol ---- 0,01 mol --- /
Ao finai da reação, há 0,02 mol de NaOH em 500 mL de solução (V1+V2). A partir disso, é possível calcular o pH. Cálculo:
[NaOH] = 0,02 mol / 0,500 L = 0,04 mol/L
Dissociação Iônica:
NaOH(aq) --> Na+(aq) + OH-(aq)
Veja que: [NaOH] = [OH-]
pOH:
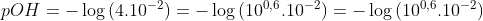
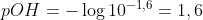
pH:
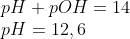
Espero que lhe ajude. )
)
V1 = 0,100 L solução HCl
V2 = 0,400 L solução NaOH
V = V1+V2 = 0,500 L (após a mistura das soluções)
Resolução:
n (HCl) = m/M = (0,365 g)/(36,5 g/mol) = 0,01 mol
n (NaOH) = [NaOH]. V2 = (0,075 mol/L).(0,400 L) = 0,03 mol
Neutralização: (Desconsidere a água produzida na reação)
-------------- HCl(aq) + NaOH(aq) --> NaCl(aq) + H2O(l)
Início: ----- 0,01 mol --- 0,03 mol ------ 0 ----------- 0
Variação: -- -0,01 mol -- -0,01 mol -- +0,01 mol ---- /
Final: ------- 0 --------- 0,02 mol ---- 0,01 mol --- /
Ao finai da reação, há 0,02 mol de NaOH em 500 mL de solução (V1+V2). A partir disso, é possível calcular o pH. Cálculo:
[NaOH] = 0,02 mol / 0,500 L = 0,04 mol/L
Dissociação Iônica:
NaOH(aq) --> Na+(aq) + OH-(aq)
Veja que: [NaOH] = [OH-]
pOH:
pH:
Espero que lhe ajude.

schow- Jedi

- Mensagens : 446
Data de inscrição : 03/01/2013
Idade : 29
Localização : Fortaleza-CE
 Re: Questão MACKENZIE -PH
Re: Questão MACKENZIE -PH
Muito obrigada =D
PS^:Ali no final acho que vc se enganou, é (1,4) e não (1,6)
PS^:Ali no final acho que vc se enganou, é (1,4) e não (1,6)

fermesquitaa- Iniciante
- Mensagens : 8
Data de inscrição : 24/09/2013
Idade : 30
Localização : São Paulo
 Re: Questão MACKENZIE -PH
Re: Questão MACKENZIE -PH
fermesquitaa escreveu:Muito obrigada =D
PS^:Ali no final acho que vc se enganou, é (1,4) e não (1,6)
;]

schow- Jedi

- Mensagens : 446
Data de inscrição : 03/01/2013
Idade : 29
Localização : Fortaleza-CE
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












