Calores de reação e energia de ligação [3]
2 participantes
Página 1 de 1
![Calores de reação e energia de ligação [3] Empty](https://2img.net/i/empty.gif) Calores de reação e energia de ligação [3]
Calores de reação e energia de ligação [3]
(UFMG/Adaptado) Os metais alcalinos, ao reagirem com água, produzem soluções dos respectivos hidróxidos e gás hidrogênio.
A tabela a seguir apresenta os dados termoquímicos que permitem a obtenção das equações das reações globais e de seus respectivos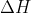
![Calores de reação e energia de ligação [3] 23738385](https://2img.net/r/ihimizer/img560/6961/23738385.png)
1. Considerando os dados dessa tabela, ESCREVA a equação balanceada da reação global entre o potássio metálico e a água.
2. CALCULE a variação de entalpia para a reação entre o potássio metálico e a água, conforme mostrado no item 1. (Deixe seus cálculos registrados, explicitando, assim, seu raciocínio).
Tentativa:
1. K + H2O -----> KOH + 1/2 H2
2. Não sei fazer, mas acho que vai sair pelo cálculo do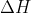 a partir do calor de formação.
a partir do calor de formação.
Gabarito:
1. K + H2O -----> K+ + OH- + 1/2 H2
2.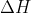 = -197 KJ/mol
= -197 KJ/mol
Desejo saber se a minha tentativa da nº 1 está correta e como resolvo a nº 2 ???
A tabela a seguir apresenta os dados termoquímicos que permitem a obtenção das equações das reações globais e de seus respectivos
![Calores de reação e energia de ligação [3] 23738385](https://2img.net/r/ihimizer/img560/6961/23738385.png)
1. Considerando os dados dessa tabela, ESCREVA a equação balanceada da reação global entre o potássio metálico e a água.
2. CALCULE a variação de entalpia para a reação entre o potássio metálico e a água, conforme mostrado no item 1. (Deixe seus cálculos registrados, explicitando, assim, seu raciocínio).
Tentativa:
1. K + H2O -----> KOH + 1/2 H2
2. Não sei fazer, mas acho que vai sair pelo cálculo do
Gabarito:
1. K + H2O -----> K+ + OH- + 1/2 H2
2.
Desejo saber se a minha tentativa da nº 1 está correta e como resolvo a nº 2 ???

Kelvin Brayan- Mestre Jedi

- Mensagens : 742
Data de inscrição : 05/04/2011
Idade : 31
Localização : Santa Rita do Sapucaí - MG
![Calores de reação e energia de ligação [3] Empty](https://2img.net/i/empty.gif) Re: Calores de reação e energia de ligação [3]
Re: Calores de reação e energia de ligação [3]
Some todas as reações e respectivos ΔH:
K(s) --> K(g) (+89)
K(g) --> K(g) + 1 e- (+425)
K(g) --> K+(aq) (-767)
H2O(l) + 1 e- --> OH-(aq) + 1/2 H2 (g) (+56)
=========================================
K(s) + H20 --> K+(aq) + OH-(aq) + 1/2 H2(g) (-197)
O que estiver em lados opostos, se anulam...
Tendo cuidado com os coeficientes estequiométricos ...
Nesse caso, nada a fazer, só somar
K(s) --> K(g) (+89)
K(g) --> K(g) + 1 e- (+425)
K(g) --> K+(aq) (-767)
H2O(l) + 1 e- --> OH-(aq) + 1/2 H2 (g) (+56)
=========================================
K(s) + H20 --> K+(aq) + OH-(aq) + 1/2 H2(g) (-197)
O que estiver em lados opostos, se anulam...
Tendo cuidado com os coeficientes estequiométricos ...
Nesse caso, nada a fazer, só somar
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
![Calores de reação e energia de ligação [3] Empty](https://2img.net/i/empty.gif) Re: Calores de reação e energia de ligação [3]
Re: Calores de reação e energia de ligação [3]
Obrigado, rihan!

Kelvin Brayan- Mestre Jedi

- Mensagens : 742
Data de inscrição : 05/04/2011
Idade : 31
Localização : Santa Rita do Sapucaí - MG
![Calores de reação e energia de ligação [3] Empty](https://2img.net/i/empty.gif) Re: Calores de reação e energia de ligação [3]
Re: Calores de reação e energia de ligação [3]
ΔHoreação = Σ ΔHo produtos - Σ ΔHo reagentes (Lei de Hess)
Lembrando-se de que:
1) ΔHo é J/mol, isso é, por 1 mol, ao balancear reações, considere.
2) Reação inversa, inverte-se o sinal de ΔHo .
3) ΔHo de formação dos elementos em seu alótropo mais abundante, em seu estado físico normal a 25°C e 1 atm é ZERO .
H2 gas ΔHo formação = 0
Br2 líquido ΔHo formação = 0
Br2 gas ΔHo formação = 111,8 kJ/mol
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil

Kelvin Brayan- Mestre Jedi

- Mensagens : 742
Data de inscrição : 05/04/2011
Idade : 31
Localização : Santa Rita do Sapucaí - MG
![Calores de reação e energia de ligação [3] Empty](https://2img.net/i/empty.gif) Re: Calores de reação e energia de ligação [3]
Re: Calores de reação e energia de ligação [3]
E Vamos Lá ! 
rihan- Estrela Dourada

- Mensagens : 5049
Data de inscrição : 22/08/2011
Idade : 69
Localização : Rio de Janeiro, RJ, Itabuna-Ilhéus, BA, Brasil
 Tópicos semelhantes
Tópicos semelhantes» Calores de reação e energia de ligação [4]
» Calores de reação e energia de ligação [5]
» Calores de reação e energia de ligação [6]
» Calores de reação e energia de ligação
» Calores de Reação e Energia de Ligação [ULTIMATE]
» Calores de reação e energia de ligação [5]
» Calores de reação e energia de ligação [6]
» Calores de reação e energia de ligação
» Calores de Reação e Energia de Ligação [ULTIMATE]
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|


![Calores de reação e energia de ligação [3] T3Ri1xW](https://i.imgur.com/T3Ri1xW.png)










