|ALCANOS| - Calor de combustão
2 participantes
PiR2 :: Química :: Química Orgânica
Página 1 de 1
 |ALCANOS| - Calor de combustão
|ALCANOS| - Calor de combustão
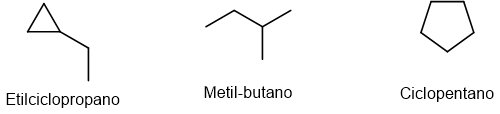
Organize por ordem crescente de valor absoluto do calor de combustão os seguintes alcanos: etilciclopropano, metil-butano e ciclopentano.
Vejam se concordam com minha resposta:
As fórmulas estruturais são:
- GABARITO:
- S/ Gabarito
Vejam se concordam com minha resposta:
As fórmulas estruturais são:

- MINHA RESPOSTA:
Todos os compostos possuem mesmas quantidades de carbono, portanto, devemos observar os outros fatores que podem influenciar no calor de combustão dos alcanos: ramificações e existência de ciclos.
O Ciclopentano é o mais estável devido ao relaxamento de tensões que sua estrutura pentagonal o fornece, portanto, deve possuir maior calor de combustão.
O etilciclopropano é um ciclano triangular, o que vai fornecer a ele uma desestabilidade considerável. Por isso, deve ser o de menor calor de combustão.
O metil-butano, por sua vez, terá calor de combustão intermediário dentre os demais.
Et-Cicloprop < Met-but < Ciclopentano
Última edição por Arlindocampos07 em Ter 19 Jul 2022, 09:07, editado 1 vez(es)

Arlindocampos07- Mestre Jedi

- Mensagens : 506
Data de inscrição : 22/02/2022
Idade : 20
Localização : Cajazeiras, Paraíba, Brasil
 Re: |ALCANOS| - Calor de combustão
Re: |ALCANOS| - Calor de combustão
Olá colega;
Creio que você ficou um pouco perdido na relação entre a estabilidade e a energia que será liberada. Quanto mais estável a substância, menor será a energia que ela irá liberar na combustão. Afinal, a instabilidade está relacionada a um teor maior de energia presente no composto. Quanto maior a energia disponível para a reação, maior será a energia liberada.
Pela teoria das tensões dos anéis de Bayer, quanto menor o número de metilenos (CH2) de um ciclano em relação ao cicloexano, mais instável será a substância devido a presença das tensões angulares. Assim, a ordem resumida de estabilidade dos grupos metileno de alguns compostos de interesse:
Hexano ≈ Cicloexano > Ciclopentano > Ciclopropano .
Considerando que a estrutura ciclopropil é relativamente muito instável, podemos prever a ordem da estabilidade dos grupos metileno:
Hexano ≈ Cicloexano > Ciclopentano > Etilciclopropano
Quanto aos hidrocarbonetos alifáticos, a presença de ramificações tende a abaixar o calor de formação do composto em relação ao seu isômero não ramificado. Por consequência, o hidrocarboneto alifático ramificado tende a ser mais estável que o isômero não ramificado. Assim podemos prever a ordem de estabilidade dos compostos :
Metilbutano > Pentano
Como o pentano e o hexano não possuem tensão angular, podemos prever a ordem de estabilidade por unidade de CH2 :
Pentano = hexano
( como esses alcanos não são estritamente compostos por grupos metileno, a maneira mais correta seria enxergar como uma média da energia por número de carbonos)
Tomando o resultado líquido das inequações:
Metilbutano > Pentano = Hexano ≈ Cicloexano > Ciclopentano > Etilciclopropano -->
Metilbutano > ciclopentano > Etilciclopropano
Como foi discutido, maior a estabilidade, menor é a energia liberada na combustão .A ordem dos calores de combustão prevista será:
Metilbutano < ciclopentano < Etilciclopropano
Eis uma tabela de dados retirado do livro do Solomons e Fryhle Vol 1 para ilustrar parte da teoria discutida com o aval experimental:

Bons estudos
Creio que você ficou um pouco perdido na relação entre a estabilidade e a energia que será liberada. Quanto mais estável a substância, menor será a energia que ela irá liberar na combustão. Afinal, a instabilidade está relacionada a um teor maior de energia presente no composto. Quanto maior a energia disponível para a reação, maior será a energia liberada.
Pela teoria das tensões dos anéis de Bayer, quanto menor o número de metilenos (CH2) de um ciclano em relação ao cicloexano, mais instável será a substância devido a presença das tensões angulares. Assim, a ordem resumida de estabilidade dos grupos metileno de alguns compostos de interesse:
Hexano ≈ Cicloexano > Ciclopentano > Ciclopropano .
Considerando que a estrutura ciclopropil é relativamente muito instável, podemos prever a ordem da estabilidade dos grupos metileno:
Hexano ≈ Cicloexano > Ciclopentano > Etilciclopropano
Quanto aos hidrocarbonetos alifáticos, a presença de ramificações tende a abaixar o calor de formação do composto em relação ao seu isômero não ramificado. Por consequência, o hidrocarboneto alifático ramificado tende a ser mais estável que o isômero não ramificado. Assim podemos prever a ordem de estabilidade dos compostos :
Metilbutano > Pentano
Como o pentano e o hexano não possuem tensão angular, podemos prever a ordem de estabilidade por unidade de CH2 :
Pentano = hexano
( como esses alcanos não são estritamente compostos por grupos metileno, a maneira mais correta seria enxergar como uma média da energia por número de carbonos)
Tomando o resultado líquido das inequações:
Metilbutano > Pentano = Hexano ≈ Cicloexano > Ciclopentano > Etilciclopropano -->
Metilbutano > ciclopentano > Etilciclopropano
Como foi discutido, maior a estabilidade, menor é a energia liberada na combustão .A ordem dos calores de combustão prevista será:
Metilbutano < ciclopentano < Etilciclopropano
Eis uma tabela de dados retirado do livro do Solomons e Fryhle Vol 1 para ilustrar parte da teoria discutida com o aval experimental:

Bons estudos

joaoZacharias- Recebeu o sabre de luz

- Mensagens : 134
Data de inscrição : 18/03/2020
Localização : Campinas - SP, BR
Arlindocampos07 gosta desta mensagem
 Re: |ALCANOS| - Calor de combustão
Re: |ALCANOS| - Calor de combustão
Opa, João!
Realmente, me embolei todo com os conceitos!
Ainda não tive contato com termoquímica, por isso acabei misturando tudo quando tentei ir pelas noções que tinha. Muito obrigado pela explicação, cara!
Realmente, me embolei todo com os conceitos!
Ainda não tive contato com termoquímica, por isso acabei misturando tudo quando tentei ir pelas noções que tinha. Muito obrigado pela explicação, cara!

Arlindocampos07- Mestre Jedi

- Mensagens : 506
Data de inscrição : 22/02/2022
Idade : 20
Localização : Cajazeiras, Paraíba, Brasil
 Tópicos semelhantes
Tópicos semelhantes» calor de combustão
» O calor de combustão de um alcano....
» FUVEST - Calor de combustão
» O calor de combustão de um dado hidrocarbonet
» Potência, Rendimento e Calor de combustão
» O calor de combustão de um alcano....
» FUVEST - Calor de combustão
» O calor de combustão de um dado hidrocarbonet
» Potência, Rendimento e Calor de combustão
PiR2 :: Química :: Química Orgânica
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












