Mackenzie - SP
2 participantes
Página 1 de 1
 Mackenzie - SP
Mackenzie - SP
Na reação entre zinco e ácido clorídrico, há a formação de um gás altamente inflamável.
Esse gás é o:
a) gás oxigênio.
b) gás carbônico.
c) gás hidrogênio.
d) gás cloro.
e) monóxido de carbono.
Alguém poderia me explicar?
Esse gás é o:
a) gás oxigênio.
b) gás carbônico.
c) gás hidrogênio.
d) gás cloro.
e) monóxido de carbono.
Alguém poderia me explicar?
- Gabarito:
- Letra C
Última edição por dante19 em Qua 16 Dez 2020, 17:40, editado 1 vez(es)

dante19- Iniciante
- Mensagens : 38
Data de inscrição : 02/10/2020
Idade : 18
 reações
reações
é simples, isso é uma reação de simples troca. temos um metal e um ácido clorídrico. A reação vai ocorrer se o Zn for mais reativo que o H do "hcl".
Em termos simples, os metais tem grande eletropositividade (querem dar elétrons). O hidrogênio também tem grande eletropositividade em relação aos outros gases. É como se os dois estivessem disputando para ver quem fica com o elétron do cloro.
Como o Zn é mais eletropositivo (possui maior tendência de dar elétrons), ele rouba o lugar do hidrogênio.
analisando os produtos
Se o hidrogênio vai ficar sozinho, deve-se saber que ele deve ficar na forma de H2 para ficar estável. Logo, se eu tenho 2 hidrogênios nos produtos, eu devo ter dois hidrogênios nos reagentes.
logo, a reação fica
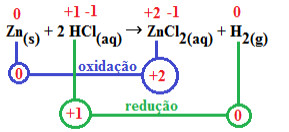
Zn+2HCl--> ZnCL2+H2
Em termos simples, os metais tem grande eletropositividade (querem dar elétrons). O hidrogênio também tem grande eletropositividade em relação aos outros gases. É como se os dois estivessem disputando para ver quem fica com o elétron do cloro.
Como o Zn é mais eletropositivo (possui maior tendência de dar elétrons), ele rouba o lugar do hidrogênio.
analisando os produtos
Se o hidrogênio vai ficar sozinho, deve-se saber que ele deve ficar na forma de H2 para ficar estável. Logo, se eu tenho 2 hidrogênios nos produtos, eu devo ter dois hidrogênios nos reagentes.
logo, a reação fica
Zn+2HCl--> ZnCL2+H2
Última edição por felipeomestre123 em Qua 16 Dez 2020, 15:46, editado 1 vez(es)

felipeomestre123- Mestre Jedi

- Mensagens : 639
Data de inscrição : 15/09/2019
Idade : 21
Localização : Foz do iguaçu-PR
Samuel007 gosta desta mensagem
 Re: Mackenzie - SP
Re: Mackenzie - SP
felipeomestre123 escreveu:é simples, isso é uma reação de simples troca. temos um metal e um ácido clorídrico. A reação vai ocorrer se o Zn for mais reativo que o H do "hcl".
Em termos simples, os metais tem grande eletropositividade (querem dar elétrons). O hidrogênio também tem grande eletropositividade em relação aos outros gases. É como se os dois estivessem disputando para que fica com o elétron do cloro.
Como o Zn é mais eletropositivo (possui maior tendência de dar elétrons), ele rouba o lugar do hidrogênio.
analisando os produtos
Se o hidrogênio vai ficar sozinho, deve-se saber que ele deve ficar na forma de H2 para ficar estável. Logo, se eu tenho 2 hidrogênios nos produtos, eu devo ter dois hidrogênios nos reagentes.
logo, a reação fica
Zn+2HCl--> ZnCL2+H2
Fiquei confuso em relação ao elemento com o qual o Zn vai reagir... Por que o Zn não reagiu com o H, formando ZnH2 + Cl2? O Zn é mais eletropositivo do que o H, logo ele poderia ceder elétrons ao H...

dante19- Iniciante
- Mensagens : 38
Data de inscrição : 02/10/2020
Idade : 18

felipeomestre123- Mestre Jedi

- Mensagens : 639
Data de inscrição : 15/09/2019
Idade : 21
Localização : Foz do iguaçu-PR
 Re: Mackenzie - SP
Re: Mackenzie - SP
Muito obrigado, mestre!

dante19- Iniciante
- Mensagens : 38
Data de inscrição : 02/10/2020
Idade : 18
 Re: Mackenzie - SP
Re: Mackenzie - SP
Só para complementar, Dante.
Tome cuidado com reações com H2O. Nem sempre a espécie simples toma o lugar do elemento como inteiro.
exemplo.
metais da 1A e Metais da 2A+ H2O---> hidróxido+H2
mas, pode ficar tranquilo que:
Metais que não sejam 1A e 2A+ H2O---> Óxido+H2
De qualquer forma, a reação liberará o H2, mas é importante ressaltar que, nem sempre reações de metais com H2O serão reações de simples troca.
Resumindo, aqui está o que é dito no livro do Feltre:
Reações com a água
Os metais alcalinos e alcalino-terrosos reagem com a água em temperatura ambiente, formando
os hidróxidos correspondentes:
2 Na +2 H2O -->2 NaOH + H2
Ca + 2 H2O -->Ca(OH)2 + H2
Os metais comuns só reagem com a água por aquecimento, formando os óxidos correspondentes:
Zn + H2O--->ZnO + H2
3 Fe + 4 H2O--> Fe3O4 + 4 H2
Os metais nobres (Cu, Hg, Ag, Pt e Au) não reagem com a água
Tome cuidado com reações com H2O. Nem sempre a espécie simples toma o lugar do elemento como inteiro.
exemplo.
metais da 1A e Metais da 2A+ H2O---> hidróxido+H2
mas, pode ficar tranquilo que:
Metais que não sejam 1A e 2A+ H2O---> Óxido+H2
De qualquer forma, a reação liberará o H2, mas é importante ressaltar que, nem sempre reações de metais com H2O serão reações de simples troca.
Resumindo, aqui está o que é dito no livro do Feltre:
Reações com a água
Os metais alcalinos e alcalino-terrosos reagem com a água em temperatura ambiente, formando
os hidróxidos correspondentes:
2 Na +2 H2O -->2 NaOH + H2
Ca + 2 H2O -->Ca(OH)2 + H2
Os metais comuns só reagem com a água por aquecimento, formando os óxidos correspondentes:
Zn + H2O--->ZnO + H2
3 Fe + 4 H2O--> Fe3O4 + 4 H2
Os metais nobres (Cu, Hg, Ag, Pt e Au) não reagem com a água

felipeomestre123- Mestre Jedi

- Mensagens : 639
Data de inscrição : 15/09/2019
Idade : 21
Localização : Foz do iguaçu-PR
 Re: Mackenzie - SP
Re: Mackenzie - SP
Isso que foi dito acima é somente válido para o caso do H2O!

felipeomestre123- Mestre Jedi

- Mensagens : 639
Data de inscrição : 15/09/2019
Idade : 21
Localização : Foz do iguaçu-PR
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|