Reações Químicas - ( Uncisal 2018 )
2 participantes
Página 1 de 1
 Reações Químicas - ( Uncisal 2018 )
Reações Químicas - ( Uncisal 2018 )
32. O principal constituinte mineralógico do calcário é a calcita, que contém grande quantidade
de carbonato de cálcio. A decomposição térmica (calcinação) do calcário gera a cal virgem,
CaO, matéria-prima para a produção de cimento e muito utilizada na agricultura para reduzir
a acidez do solo (calagem). Com base em reações que envolvem o carbonato de cálcio e o
óxido de cálcio, assinale a alternativa correta.
Dado: Kps (CaCO3) = 4,7x10-9
(A) A reação do óxido de cálcio com água forma o hidróxido de cálcio, muito utilizado como agente
coagulante em estações de tratamento de água.
(B) A mistura de 1,0x10-5 mol de íons Ca2+ e 5,0x10-5 mol de íon CO3
2-, em 1,0 L de água, resulta em
uma solução saturada de carbonato de cálcio.
(C) O óxido de cálcio apresenta caráter anfótero.
(D) A adição da cal virgem a uma solução aquosa de ácido clorídrico, com reação completa, resulta em
uma solução ácida.
(E) A massa de óxido de cálcio formada pela decomposição térmica de 100 g de carbonato de cálcio,
considerando um rendimento de 80%, é 44,8 g.
Gabarito : E
[Fiquei em dúvida entre a E e a B ]
de carbonato de cálcio. A decomposição térmica (calcinação) do calcário gera a cal virgem,
CaO, matéria-prima para a produção de cimento e muito utilizada na agricultura para reduzir
a acidez do solo (calagem). Com base em reações que envolvem o carbonato de cálcio e o
óxido de cálcio, assinale a alternativa correta.
Dado: Kps (CaCO3) = 4,7x10-9
(A) A reação do óxido de cálcio com água forma o hidróxido de cálcio, muito utilizado como agente
coagulante em estações de tratamento de água.
(B) A mistura de 1,0x10-5 mol de íons Ca2+ e 5,0x10-5 mol de íon CO3
2-, em 1,0 L de água, resulta em
uma solução saturada de carbonato de cálcio.
(C) O óxido de cálcio apresenta caráter anfótero.
(D) A adição da cal virgem a uma solução aquosa de ácido clorídrico, com reação completa, resulta em
uma solução ácida.
(E) A massa de óxido de cálcio formada pela decomposição térmica de 100 g de carbonato de cálcio,
considerando um rendimento de 80%, é 44,8 g.
Gabarito : E
[Fiquei em dúvida entre a E e a B ]

caiqueandree- Iniciante
- Mensagens : 45
Data de inscrição : 06/05/2017
Idade : 28
Localização : Ibitiara Bahia Brasil
 Re: Reações Químicas - ( Uncisal 2018 )
Re: Reações Químicas - ( Uncisal 2018 )
Oi, bom dia.
Então, vou resolver os itens que você ficou em dúvida.
No item b), temos essa mistura de mol num litro de água. Para descobrirmos se a solução é saturada ou não, basta olharmos pelo Kps (produto de solubilidade) do carbonato de cálcio.
Se o Kps é um produto de solubilidade, multiplique os valores das molaridades desses íons para descobrir o Kps dessa determinada mistura. Sendo a molaridade definida pela divisão entre o número de mol da substância e o volume da solução, o número de mol de cada íon é igual a sua molaridade.
Agora, realizando a multiplicação de ambas, temos o resultado do produto iônico igual a
Se o produto iônico possui valor inferior ao produto de solubilidade, a dita solução é insaturada, e não saturada (como o item diz ser). Seria saturada se eles tivessem valores iguais.
Já no item e), é uma estequiometria simples. A massa molar do carbonato de cálcio equivale a 100g e a do óxido de cálcio vale 56g.
Se, em 100%, há a produção de 56g de CaO a cada 100g de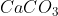 (o que equivale a um mol), teremos 44,8g em 80% (basta multiplicar 56g por 0,8 ou
(o que equivale a um mol), teremos 44,8g em 80% (basta multiplicar 56g por 0,8 ou 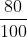 ).
).
A referida reação é: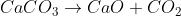
(releve a falta de estados físicos)
No item b), temos essa mistura de mol num litro de água. Para descobrirmos se a solução é saturada ou não, basta olharmos pelo Kps (produto de solubilidade) do carbonato de cálcio.
Se o Kps é um produto de solubilidade, multiplique os valores das molaridades desses íons para descobrir o Kps dessa determinada mistura. Sendo a molaridade definida pela divisão entre o número de mol da substância e o volume da solução, o número de mol de cada íon é igual a sua molaridade.
Agora, realizando a multiplicação de ambas, temos o resultado do produto iônico igual a
Se o produto iônico possui valor inferior ao produto de solubilidade, a dita solução é insaturada, e não saturada (como o item diz ser). Seria saturada se eles tivessem valores iguais.
Já no item e), é uma estequiometria simples. A massa molar do carbonato de cálcio equivale a 100g e a do óxido de cálcio vale 56g.
Se, em 100%, há a produção de 56g de CaO a cada 100g de
A referida reação é:
(releve a falta de estados físicos)

Dextrógiro- Padawan

- Mensagens : 54
Data de inscrição : 16/08/2019
Idade : 23
Localização : Fortaleza, Ceará, Brasil
 Tópicos semelhantes
Tópicos semelhantes» (UEPG PSS - 2018) Reações Químicas
» Reações químicas
» Reações químicas
» Reações químicas
» Reações químicas
» Reações químicas
» Reações químicas
» Reações químicas
» Reações químicas
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












