UEM verão 2016 - Concentrações
2 participantes
Página 1 de 1
 UEM verão 2016 - Concentrações
UEM verão 2016 - Concentrações
33. Em um laboratório, há duas provetas idênticas em formato de cilindros circulares retos cujas alturas são o triplo do raio da base. Suponha que metade de cada proveta está ocupada com 324π cm3 de água pura e considere dois experimentos:
I - Ao colocar-se em uma das provetas um parafuso de cobre de densidade 9 g/cm3, o nível da água sobre 3 cm.
II - Ao colocar-se na outra proveta uma porção de glicose líquida (C6H12O6) de densidade 1,5 g/cm3, o nível da água sobre 2 cm.
Suponha, também, que uma solução homogênea preparada a partir de 100 mL de água pura e 50 mL de glicose líquida tem um volume de 148 mL. Com base nestas informações, assinale o que for correto.
04) Há o triplo de número de mols de átomos de cobre no parafuso em relação ao número de mols de moléculas de água em uma das provetas.
08) No segundo experimento, foi acrescentado menos que 9/5 mols de moléculas de glicose.
Quero saber como faz essas duas assertivas (ambas são falsas)
I - Ao colocar-se em uma das provetas um parafuso de cobre de densidade 9 g/cm3, o nível da água sobre 3 cm.
II - Ao colocar-se na outra proveta uma porção de glicose líquida (C6H12O6) de densidade 1,5 g/cm3, o nível da água sobre 2 cm.
Suponha, também, que uma solução homogênea preparada a partir de 100 mL de água pura e 50 mL de glicose líquida tem um volume de 148 mL. Com base nestas informações, assinale o que for correto.
04) Há o triplo de número de mols de átomos de cobre no parafuso em relação ao número de mols de moléculas de água em uma das provetas.
08) No segundo experimento, foi acrescentado menos que 9/5 mols de moléculas de glicose.
Quero saber como faz essas duas assertivas (ambas são falsas)

Japagridoce- Iniciante
- Mensagens : 15
Data de inscrição : 15/01/2016
Idade : 25
Localização : Londrina, PR
 Re: UEM verão 2016 - Concentrações
Re: UEM verão 2016 - Concentrações
Raio da base: r
Altura : 3r
Massa molar do cobre: 63,5 g / mol
Massa molar da glicose: 180 g / mol
Volume cilindro = Ab.h → V = pi.r².3r → V = 3.pi.r³
Foi dado que metade do volume vale 324pi, assim:
0,5V = 1,5.pi.r³
324pi = 1,5.pi.r³
r = 6 cm
h = 18 cm
04) Falsa
Sabemos que o volume de água deslocado será igual ao volume do prego. Calculando esse volume:
V = Ab.h'
V = pi.r².3
V = 108pi cm³
Cálculo da massa de cobre:
d = m/v
9 = m / 108pi
m = 108.9.pi gramas
Cálculo do número de mols de cobre:
n1 = m / M
n1 = 108.9.pi / 63,5 (I)
Cáluclo da massa de água:
d = m / v
1 = m / 324pi
m = 324pi gramas
Cálculo do número de mols de água:
n2 = m / M
n2 = 324pi / 18 (II)
Dividindo (I) por (II):
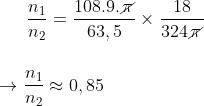
08) Falsa
Sabemos que o acréscimo de 50 ml de glicose geral um aumento de 48 ml da solução.
Então é como se, do volume que acrescentamos de glicose, apenas 96% alterasse o volume da solução.
Cálculo do volume de glicose:
V = Ab.h
V = 36pi.2
V = 72pi
0,96V' = 72pi
V' = 75pi
Cálculo da massa de glicose:
d = m / v
1,5 = m / 75pi
m = 75pi.1,5 gramas
Cálculo do número de mols de glicose:
n = m / M
n = 75pi.1,5 / 180
n ≈ 1,96 mols
1,96 > 1,8
Altura : 3r
Massa molar do cobre: 63,5 g / mol
Massa molar da glicose: 180 g / mol
Volume cilindro = Ab.h → V = pi.r².3r → V = 3.pi.r³
Foi dado que metade do volume vale 324pi, assim:
0,5V = 1,5.pi.r³
324pi = 1,5.pi.r³
r = 6 cm
h = 18 cm
04) Falsa
Sabemos que o volume de água deslocado será igual ao volume do prego. Calculando esse volume:
V = Ab.h'
V = pi.r².3
V = 108pi cm³
Cálculo da massa de cobre:
d = m/v
9 = m / 108pi
m = 108.9.pi gramas
Cálculo do número de mols de cobre:
n1 = m / M
n1 = 108.9.pi / 63,5 (I)
Cáluclo da massa de água:
d = m / v
1 = m / 324pi
m = 324pi gramas
Cálculo do número de mols de água:
n2 = m / M
n2 = 324pi / 18 (II)
Dividindo (I) por (II):
08) Falsa
Sabemos que o acréscimo de 50 ml de glicose geral um aumento de 48 ml da solução.
Então é como se, do volume que acrescentamos de glicose, apenas 96% alterasse o volume da solução.
Cálculo do volume de glicose:
V = Ab.h
V = 36pi.2
V = 72pi
0,96V' = 72pi
V' = 75pi
Cálculo da massa de glicose:
d = m / v
1,5 = m / 75pi
m = 75pi.1,5 gramas
Cálculo do número de mols de glicose:
n = m / M
n = 75pi.1,5 / 180
n ≈ 1,96 mols
1,96 > 1,8
igorrudolf- Jedi

- Mensagens : 434
Data de inscrição : 10/09/2014
Idade : 28
Localização : São Paulo - São Paulo
 Tópicos semelhantes
Tópicos semelhantes» UEPG Verão 2016 - Kps
» UEM verão 2016 - pH de soluções
» UEM verão 2016 - Termodinâmica
» Uem verão 2016 - decaimento radioativo
» Horário de verão
» UEM verão 2016 - pH de soluções
» UEM verão 2016 - Termodinâmica
» Uem verão 2016 - decaimento radioativo
» Horário de verão
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












