(UFPE) Ligações Químicas e Polaridade
4 participantes
Página 1 de 1
 (UFPE) Ligações Químicas e Polaridade
(UFPE) Ligações Químicas e Polaridade
Na(s) questão(ões) a seguir escreva nos parênteses a letra (V) se a afirmativa for verdadeira ou (F) se for falsa. Uma sonda espacial pousou na superfície de um planeta do nosso universo cujas temperatura ambiente e pressão atmosférica são, respectivamente, de 25 °C e 1,5 atm. Amostras coletadas forneceram dados que podem ser resumidos assim:
A) A atmosfera do planeta é composta por uma mistura equimolar de dois gases. O gás X é uma substância simples e o gás Y é uma substância composta por 3 átomos de 2 elementos da tabela periódica.
B) O solo do planeta é rico em uma substância sólida e solúvel em água. Soluções aquosas desta substância não conduzem eletricidade.
C) Amostras de um líquido encontrado na superfície do planeta revelaram que se trata de uma substância também solúvel em água. O líquido não conduz eletricidade, mas sua solução aquosa conduz.
Analise as afirmativas a seguir:
(___) O gás X é necessariamente uma substância apolar.
(___) O gás Y não pode ser uma substância apolar.
(___) O sólido analisado é provavelmente uma substância polar e definitivamente iônico.
(___) O líquido analisado é provavelmente uma substância polar e definitivamente covalente.
(___) Ambos os gases são necessariamente substâncias covalentes.
Alguém pode me explicar as duas últimas proposições, pois eu achei que elas eram falsas.
Gabarito: VFFVV
A) A atmosfera do planeta é composta por uma mistura equimolar de dois gases. O gás X é uma substância simples e o gás Y é uma substância composta por 3 átomos de 2 elementos da tabela periódica.
B) O solo do planeta é rico em uma substância sólida e solúvel em água. Soluções aquosas desta substância não conduzem eletricidade.
C) Amostras de um líquido encontrado na superfície do planeta revelaram que se trata de uma substância também solúvel em água. O líquido não conduz eletricidade, mas sua solução aquosa conduz.
Analise as afirmativas a seguir:
(___) O gás X é necessariamente uma substância apolar.
(___) O gás Y não pode ser uma substância apolar.
(___) O sólido analisado é provavelmente uma substância polar e definitivamente iônico.
(___) O líquido analisado é provavelmente uma substância polar e definitivamente covalente.
(___) Ambos os gases são necessariamente substâncias covalentes.
Alguém pode me explicar as duas últimas proposições, pois eu achei que elas eram falsas.
Gabarito: VFFVV

Giovana Martins- Grande Mestre

- Mensagens : 7618
Data de inscrição : 15/05/2015
Idade : 23
Localização : São Paulo
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
Giovana,
1. "O líquido analisado é provavelmente uma substância polar e definitivamente covalente."
Em "C": "Amostras de um líquido encontrado na superfície do planeta revelaram que se trata de uma substância também solúvel em água. O líquido não conduz eletricidade, mas sua solução aquosa conduz."
Para que um líquido seja solúvel (naturalmente) em água, ele precisa ser polar, isto é, seu momento dipolar não deve ser nulo. Será solúvel também, ainda que pouco, se existirem momentos dipolos instantâneos em pequenos intervalos de tempo, como acontece quando há o choque entre duas moléculas com momento dipolo inicial zero, por exemplo.
Logo, é mais provável que a substância seja polar.
Mas por que a substância é covalente? Bom, se o líquido não conduz eletricidade e passa a conduzir quando em solução, então ele é covalente, pois ioniza em água.
Se ele fosse iônico, teríamos a mesma coisa que acontece no exemplo abaixo:
O NaCl líquido (fundido, claro) conduz eletricidade; quando em água, também (dissociação). Se conduz nos dois modos, então sabemos que as cargas já existiam antes da adição de água.
2. Ambos os gases são necessariamente substâncias covalentes.
Giovana, peço que você pense um pouco mais nessa proposição, analisando o seguinte:
Os íons geralmente possuem um alto ponto de [...]
Os íons são sóli[...]
Se ainda não tiver compreendido esta última, tento ilustrar a situação. É só avisar.
Bons estudos!
1. "O líquido analisado é provavelmente uma substância polar e definitivamente covalente."
Em "C": "Amostras de um líquido encontrado na superfície do planeta revelaram que se trata de uma substância também solúvel em água. O líquido não conduz eletricidade, mas sua solução aquosa conduz."
Para que um líquido seja solúvel (naturalmente) em água, ele precisa ser polar, isto é, seu momento dipolar não deve ser nulo. Será solúvel também, ainda que pouco, se existirem momentos dipolos instantâneos em pequenos intervalos de tempo, como acontece quando há o choque entre duas moléculas com momento dipolo inicial zero, por exemplo.
Logo, é mais provável que a substância seja polar.
Mas por que a substância é covalente? Bom, se o líquido não conduz eletricidade e passa a conduzir quando em solução, então ele é covalente, pois ioniza em água.
Se ele fosse iônico, teríamos a mesma coisa que acontece no exemplo abaixo:
O NaCl líquido (fundido, claro) conduz eletricidade; quando em água, também (dissociação). Se conduz nos dois modos, então sabemos que as cargas já existiam antes da adição de água.
2. Ambos os gases são necessariamente substâncias covalentes.
Giovana, peço que você pense um pouco mais nessa proposição, analisando o seguinte:
Os íons geralmente possuem um alto ponto de [...]
Os íons são sóli[...]
Se ainda não tiver compreendido esta última, tento ilustrar a situação. É só avisar.
Bons estudos!
Última edição por AleeZl em Qua 26 Out 2016, 00:22, editado 1 vez(es)

AleeZl- Jedi

- Mensagens : 355
Data de inscrição : 12/09/2015
Idade : 27
Localização : São Paulo
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
Amostras de um líquido encontrado na superfície do planeta revelaram que se trata de uma substância também solúvel em água.O líquido não conduz eletricidade, mas sua solução aquosa conduz.
Ligações covalentes não conduzem eletricidade . São formadas por Ametal x Ametal e Ametal X Hidrogênio
polar = pois possui hidroxila que é polar . OBS : Se fosse uma cadeia de hidrocarbonetos não conduzia , pois é apolar .
A atmosfera do planeta é composta por uma mistura equimolar de dois gases. O gás X é uma substância simples e o gás Y é uma substância composta por 3 átomos de 2 elementos da tabela periódica.
Todo gás é ametal , ou seja , é necessariamente covalente , independente do gás que compõe a substância química .
Ligações covalentes não conduzem eletricidade . São formadas por Ametal x Ametal e Ametal X Hidrogênio
polar = pois possui hidroxila que é polar . OBS : Se fosse uma cadeia de hidrocarbonetos não conduzia , pois é apolar .
A atmosfera do planeta é composta por uma mistura equimolar de dois gases. O gás X é uma substância simples e o gás Y é uma substância composta por 3 átomos de 2 elementos da tabela periódica.
Todo gás é ametal , ou seja , é necessariamente covalente , independente do gás que compõe a substância química .

Luan Henrique Silva Melo- Jedi

- Mensagens : 348
Data de inscrição : 29/06/2016
Idade : 26
Localização : Lages/SC
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
Luan,Luan Henrique Silva Melo escreveu:polar = pois possui hidroxila que é polar . OBS : Se fosse uma cadeia de hidrocarbonetos não conduzia , pois é apolar .
Muito cuidado: não é a hidroxila que define se um composto é polar ou não (pelo que entendi de sua frase acima), mas sim a diferença de eletronegatividade e a geometria da molécula (que permite ou não um dipolo resultante diferente de zero). Veja os contraexemplos:


Peço desculpas caso tenha interpretado mal a sua afirmação.

AleeZl- Jedi

- Mensagens : 355
Data de inscrição : 12/09/2015
Idade : 27
Localização : São Paulo
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
AleeZl escreveu:Luan,Luan Henrique Silva Melo escreveu:polar = pois possui hidroxila que é polar . OBS : Se fosse uma cadeia de hidrocarbonetos não conduzia , pois é apolar .
Muito cuidado: não é a hidroxila que define se um composto é polar ou não (pelo que entendi de sua frase acima), mas sim a diferença de eletronegatividade e a geometria da molécula (que permite ou não um dipolo resultante diferente de zero). Veja os contraexemplos:
Peço desculpas caso tenha interpretado mal a sua afirmação.
SUponha que temos uma cadeia formada por hidrocarbonetos e na ponta uma hidroxila . A cadeia de carbono e hidrogênio é apolar , mas a hidroxila é polar. Se a molécula possuir mesmo que apenas um elemento diferente de carbono e hidrogênio , ela será polar .
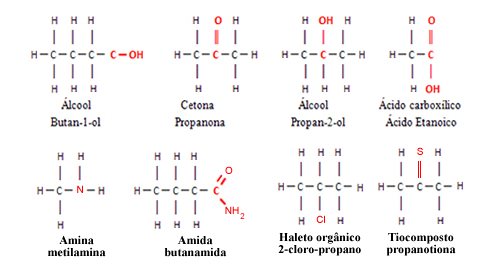

Luan Henrique Silva Melo- Jedi

- Mensagens : 348
Data de inscrição : 29/06/2016
Idade : 26
Localização : Lages/SC
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
Isso só acontece porque a diferença de eletronegatividade e a geometria permitem que haja um vetor dipolar resultante.
Se no caso a diferença de eletronegatividade como você disse acima, for em apenas uma parte da molécula, realmente, torna a molécula polar, porque teremos um vetor resultante. O problema é que essa definição de "se a molécula possuir mesmo que apenas um elemento diferente de carbono e hidrogênio, ela será polar" não pode ser generalizada. Veja:
Se em ambas as extremidades você tiver moléculas diferentes do carbono e hidrogênio, e os vetores dipolares se anularem (se assim a geometria permitir), a molécula será apolar.
Nesse caso, polares são as ligações. A molécula, no entanto, não. Um exemplo disso (mesmo que fuja dos hidrocarbonetos propriamente ditos), é a molécula de CO2 (e isso se aplica em cadeias orgânicas, também, basta analisar uma em que os vetores se anulam). Veja que há a diferença de eletronegatividade, o que faria a molécula ser polar. No entanto, como há oxigênio nos dois lados, os vetores dipolares se anulam, deixando a molécula apolar. Logo, temos ligações polares, mas uma molécula apolar:

Caso queira um exemplo orgânico, temos o tetracloreto de carbono, CCl4, em que as ligações são polares, mas como o dipolo resultante é nulo, a molécula é apolar. Então devemos ficar atentos onde estão os polos formados e se não há anulação dos mesmos na cadeia de acordo com a geometria.

Agradeço pelos complementos.
Bons estudos!
Se no caso a diferença de eletronegatividade como você disse acima, for em apenas uma parte da molécula, realmente, torna a molécula polar, porque teremos um vetor resultante. O problema é que essa definição de "se a molécula possuir mesmo que apenas um elemento diferente de carbono e hidrogênio, ela será polar" não pode ser generalizada. Veja:
Se em ambas as extremidades você tiver moléculas diferentes do carbono e hidrogênio, e os vetores dipolares se anularem (se assim a geometria permitir), a molécula será apolar.
Nesse caso, polares são as ligações. A molécula, no entanto, não. Um exemplo disso (mesmo que fuja dos hidrocarbonetos propriamente ditos), é a molécula de CO2 (e isso se aplica em cadeias orgânicas, também, basta analisar uma em que os vetores se anulam). Veja que há a diferença de eletronegatividade, o que faria a molécula ser polar. No entanto, como há oxigênio nos dois lados, os vetores dipolares se anulam, deixando a molécula apolar. Logo, temos ligações polares, mas uma molécula apolar:

Caso queira um exemplo orgânico, temos o tetracloreto de carbono, CCl4, em que as ligações são polares, mas como o dipolo resultante é nulo, a molécula é apolar. Então devemos ficar atentos onde estão os polos formados e se não há anulação dos mesmos na cadeia de acordo com a geometria.

Agradeço pelos complementos.
Bons estudos!

AleeZl- Jedi

- Mensagens : 355
Data de inscrição : 12/09/2015
Idade : 27
Localização : São Paulo
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
Muito obrigada a ambos.

Giovana Martins- Grande Mestre

- Mensagens : 7618
Data de inscrição : 15/05/2015
Idade : 23
Localização : São Paulo
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
Ora, então como você explicaria a condutividade elétrica do grafite, já que ligações covalentes não conduzem eletricidade?Luan Henrique Silva Melo escreveu:
Ligações covalentes não conduzem eletricidade . São formadas por Ametal x Ametal e Ametal X Hidrogênio
polar = pois possui hidroxila que é polar . OBS : Se fosse uma cadeia de hidrocarbonetos não conduzia , pois é apolar .
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
Pré-Iteano escreveu:Ora, então como você explicaria a condutividade elétrica do grafite, já que ligações covalentes não conduzem eletricidade?Luan Henrique Silva Melo escreveu:
Ligações covalentes não conduzem eletricidade . São formadas por Ametal x Ametal e Ametal X Hidrogênio
polar = pois possui hidroxila que é polar . OBS : Se fosse uma cadeia de hidrocarbonetos não conduzia , pois é apolar .
- Em suas formas puras, tanto líquidos como sólidos não conduzem corrente elétrica.
Uma exceção é a grafita, que conduz corrente elétrica na forma sólida, porque seus elétrons das ligações duplas fazem ressonância e, por isso, possuem certa mobilidade. ( através de ligações fracas de Van der Walls)

Luan Henrique Silva Melo- Jedi

- Mensagens : 348
Data de inscrição : 29/06/2016
Idade : 26
Localização : Lages/SC
 Re: (UFPE) Ligações Químicas e Polaridade
Re: (UFPE) Ligações Químicas e Polaridade
O grafite não é uma exceção (em relação a essa característica). Há outros inúmeros compostos formados por ligações covalentes e que conduzem corrente elétrica.Luan Henrique Silva Melo escreveu:Pré-Iteano escreveu:Ora, então como você explicaria a condutividade elétrica do grafite, já que ligações covalentes não conduzem eletricidade?Luan Henrique Silva Melo escreveu:
Ligações covalentes não conduzem eletricidade . São formadas por Ametal x Ametal e Ametal X Hidrogênio
polar = pois possui hidroxila que é polar . OBS : Se fosse uma cadeia de hidrocarbonetos não conduzia , pois é apolar .
- Em suas formas puras, tanto líquidos como sólidos não conduzem corrente elétrica.
Uma exceção é a grafita, que conduz corrente elétrica na forma sólida, porque seus elétrons das ligações duplas fazem ressonância e, por isso, possuem certa mobilidade. ( através de ligações fracas de Van der Walls)
Veja o poliacetileno, por exemplo: o fato de haver ligações duplas alternadas com ligações simples possibilita a condutividade - alta, nesse caso - do composto.
A mesma característica (duplas alternadas) pode ser encontrada em diversos outros exemplos.
* Além disso, ligações covalente também podem ser formadas entre metais e ametais, basta que a diferença de eletronegatividade entre os átomos das ligações seja pequena o bastante (AlCl3 é um exemplo).
____________________________________________
"Death is so terribly final, while life is full of possibilities." - Tyrion Lannister
 Tópicos semelhantes
Tópicos semelhantes» Geometria, polaridade e ligações químicas
» Ligações químicas - Estrutura e ligações do NO2
» Polaridade e ligações Dativas
» Polaridade de ligações e moléculas
» ligações químicas
» Ligações químicas - Estrutura e ligações do NO2
» Polaridade e ligações Dativas
» Polaridade de ligações e moléculas
» ligações químicas
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|














