Ângulos entre átomos de hidrogênio
3 participantes
Página 1 de 1
 Ângulos entre átomos de hidrogênio
Ângulos entre átomos de hidrogênio
Considere os compostos:
I. CH4 II. H2S III. H2O IV. H2Te V. H2Se
Qual a ordem decrescente dos ângulos entre os átomos de hidrogênio nos compostos?
.:Tudo bem que CH4 vai ter maior ângulo, pois nos outros existem pares eletrônicos não ligantes. Mas DENTRE ELES, como eu faço para comparar os ângulos? Tem algo a ver com o tamanho do átomo central? São da mesma família, então têm diferentes número de camadas.
Se sim, qual a explicação?
I. CH4 II. H2S III. H2O IV. H2Te V. H2Se

Qual a ordem decrescente dos ângulos entre os átomos de hidrogênio nos compostos?
.:Tudo bem que CH4 vai ter maior ângulo, pois nos outros existem pares eletrônicos não ligantes. Mas DENTRE ELES, como eu faço para comparar os ângulos? Tem algo a ver com o tamanho do átomo central? São da mesma família, então têm diferentes número de camadas.
Se sim, qual a explicação?

Gustavoadp- Estrela Dourada

- Mensagens : 1036
Data de inscrição : 05/07/2014
Idade : 27
Localização : Recife, PE
 Re: Ângulos entre átomos de hidrogênio
Re: Ângulos entre átomos de hidrogênio
É só fazer a geometria de cada uma (desenhar). Não tem nada a ver com camadas, família, etc.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Ângulos entre átomos de hidrogênio
Re: Ângulos entre átomos de hidrogênio
O que faz com que a geometria de II. H2S III. H2O IV. H2Te V. H2Se sejam iguais, correto?
Mas e os ângulos entre H? Eles não são iguais. Tanto que a resposta é I>III>II>V>IV
O que foi exatamente o contrário da MINHA HIPÓTESE. Nela seria I>IV>V>II>III, pois achei que quanto maior o raio da camada de valência, menor (mesmo que ligeiramente), talvez, seria a repulsão.
Mas, como dito, não é esse o raciocínio. Queria um que explicasse a resposta.
Mas e os ângulos entre H? Eles não são iguais. Tanto que a resposta é I>III>II>V>IV
O que foi exatamente o contrário da MINHA HIPÓTESE. Nela seria I>IV>V>II>III, pois achei que quanto maior o raio da camada de valência, menor (mesmo que ligeiramente), talvez, seria a repulsão.
Mas, como dito, não é esse o raciocínio. Queria um que explicasse a resposta.

Gustavoadp- Estrela Dourada

- Mensagens : 1036
Data de inscrição : 05/07/2014
Idade : 27
Localização : Recife, PE
 Re: Ângulos entre átomos de hidrogênio
Re: Ângulos entre átomos de hidrogênio
I. CH4
II. H2S
III. H2O
IV. H2Te
V. H2Se
Eu encontrei essa resposta:
IV < V < II < III < I
que bate com o gabarito.
Meu raciocício foi o seguinte: a eletronegatividade cresce na ordem:
O > S > Se > Te
Dessa forma, o par de elétrons no Te vai estar o "mais solto" possível e, por isso, vai causar maior repulsão por ocupar mais espaço. Se aumenta a repulsão, ele aproxima o par de hidrogênos e diminui o ângulo.
Assim, H2Te < H2Se < H2S < H2O < CH4-----> IV < V < II < III < I.
II. H2S
III. H2O
IV. H2Te
V. H2Se

Eu encontrei essa resposta:
IV < V < II < III < I
que bate com o gabarito.
Meu raciocício foi o seguinte: a eletronegatividade cresce na ordem:
O > S > Se > Te
Dessa forma, o par de elétrons no Te vai estar o "mais solto" possível e, por isso, vai causar maior repulsão por ocupar mais espaço. Se aumenta a repulsão, ele aproxima o par de hidrogênos e diminui o ângulo.
Assim, H2Te < H2Se < H2S < H2O < CH4-----> IV < V < II < III < I.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Ângulos entre átomos de hidrogênio
Re: Ângulos entre átomos de hidrogênio
Mas eu ainda não estou conseguindo relacionar eletronegatividade com isso. Ele pode estar "solto" em relação ao núcleo. Mas o raio da camada de valência é maior, logo o espaço disponível ao redor do núcleo é MAIOR. Com um espaço MAIOR, a força de repulsão seria MENOR (F = K.|Q|.|q|/d²), afastando o par de hidrogênios e aumentando o ângulo.

Gustavoadp- Estrela Dourada

- Mensagens : 1036
Data de inscrição : 05/07/2014
Idade : 27
Localização : Recife, PE
 Re: Ângulos entre átomos de hidrogênio
Re: Ângulos entre átomos de hidrogênio
A lei de Coulomb não é ideal para esse tipo de análise porque há muitos fatores envolvidos.
E embora o espaço disponível seja maior, a mobilidade do par de elétrons também cresce e eu diria é muito maior, de forma que esse fator é mais importante que o aumento do raio. Sabemos que a capacidade de um átomo de prender a nuvem eletrônica tem um efeito gigantesco. Basta comparar as "discrepâncias" entre compostos halogenados com F e Cl ou O, por exemplo. Então, acho que tudo leva a crer que eletronegatividade seja o fator mais importante.
E embora o espaço disponível seja maior, a mobilidade do par de elétrons também cresce e eu diria é muito maior, de forma que esse fator é mais importante que o aumento do raio. Sabemos que a capacidade de um átomo de prender a nuvem eletrônica tem um efeito gigantesco. Basta comparar as "discrepâncias" entre compostos halogenados com F e Cl ou O, por exemplo. Então, acho que tudo leva a crer que eletronegatividade seja o fator mais importante.

Ashitaka- Monitor

- Mensagens : 4365
Data de inscrição : 12/03/2013
Localização : São Paulo
 Re: Ângulos entre átomos de hidrogênio
Re: Ângulos entre átomos de hidrogênio
Postagem antiga, mas para contribuir com o material do fórum eu pensei assim:
Quanto mais eletronegativo o elemento central, mais ele "atrai" os hidrogênios para perto e quanto mais perto eles tiverem mais forte é a força de repulsão entre os hidrogênios (Lei de Coulomb: [latex]\tiny \vec F_{e} = \frac{k.Q.q}{d^2}[/latex]).
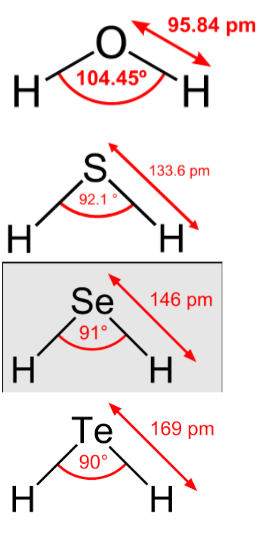
Quanto mais eletronegativo o elemento central, mais ele "atrai" os hidrogênios para perto e quanto mais perto eles tiverem mais forte é a força de repulsão entre os hidrogênios (Lei de Coulomb: [latex]\tiny \vec F_{e} = \frac{k.Q.q}{d^2}[/latex]).


Puuh Bado- Iniciante
- Mensagens : 19
Data de inscrição : 16/02/2022
Idade : 42
Localização : Insignificante
 Tópicos semelhantes
Tópicos semelhantes» Razão entre número de átomos
» Ligações entre átomos
» Distância entre átomos
» Ruptura de ligações entre átomos
» UNESPAR - Ligações entre átomos
» Ligações entre átomos
» Distância entre átomos
» Ruptura de ligações entre átomos
» UNESPAR - Ligações entre átomos
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












