Atomística
2 participantes
Página 1 de 1
 Atomística
Atomística
(UFC-2006) O CCl4 e o SiCl4, apesar de serem compostos com semelhanças em suas geometrias e na hibridação do átomo central, possuem reatividades bastante diferentes. Um deles, por exemplo, reage com água enquanto que o outro não reage. A primeira etapa dessa reação é a formação de uma espécie na qual o oxigênio da água se liga ao átomo central através de uma ligação coordenada. Com base nessas informações, assinale a alternativa correta.
a) O CCl4, por ser uma espécie bastante polar, reage com a molécula de água, enquanto que o SiCl4, apolar, não reage.
b) A maior eletronegatividade do átomo de silício, em relação ao carbono, faz com que o SiCl4 não reaja com água.
c) A presença de orbitais d vazios na camada de valência do Si faz com que o SiCl4 reaja com a molécula de H2O.
d) Como o átomo de carbono no CCl4 não obedece à regra do octeto, o mesmo pode receber elétrons da água em sua camada de valência.
e) As ligações apolares na molécula de SiCl4 fazem com que a mesma reaja com a água formando uma espécie intermediária com geometria octaédrica.
Alguém pode justificar cada alternativa, explicando porque ela está certa ou errada?
a) O CCl4, por ser uma espécie bastante polar, reage com a molécula de água, enquanto que o SiCl4, apolar, não reage.
b) A maior eletronegatividade do átomo de silício, em relação ao carbono, faz com que o SiCl4 não reaja com água.
c) A presença de orbitais d vazios na camada de valência do Si faz com que o SiCl4 reaja com a molécula de H2O.
d) Como o átomo de carbono no CCl4 não obedece à regra do octeto, o mesmo pode receber elétrons da água em sua camada de valência.
e) As ligações apolares na molécula de SiCl4 fazem com que a mesma reaja com a água formando uma espécie intermediária com geometria octaédrica.
- GABARITO:
- C
Alguém pode justificar cada alternativa, explicando porque ela está certa ou errada?
Convidado- Convidado
 Re: Atomística
Re: Atomística
Uma molécula é polar ou apolar, quando a soma dos momentos equivale a 0.
Quase todo composto formado por um elemento central e o resto das ligações pelo mesmo elemento(metano, tetracloreto de carbono) serão apolares.
Existem exceções claro, mas em geral é assim.
a) CCl4 é apolar. Descartamos.
b) Os mais eletronegativos são os elementos que possuem maior energia de ionização, e menor raio atômico. E os elementos mais eletronegativos é o fluor, oxigênio, nitrogênio, cloro, ...
O oxigênio é o segundo elemento mais eletronegativo. Descartamos a b)
c)
d) Quase todos os elementos do grupo 2 obedecem a regra do octeto(tem execeções: boro e carbono condensado são exemplos). A variação da quantidade de eletrons que pode receber decorre na maioria pelos subniveis d, e no carbono não existe o subnível 2d, então descartamos a letra d)
e) Para termos que seja uma geometria octaédrica, é necessário que haja hibridização sp³d². E isto não ocorre devido à ligações apolares do SiCl4, mas sim ao rearranjo de eletrons na sua ultima camada para formar as ligações.
O silicio só admite, se não me engano, a hibridização sp³. sp³d² seria mais para metais e gases nobres.
Quase todo composto formado por um elemento central e o resto das ligações pelo mesmo elemento(metano, tetracloreto de carbono) serão apolares.
Existem exceções claro, mas em geral é assim.
a) CCl4 é apolar. Descartamos.
b) Os mais eletronegativos são os elementos que possuem maior energia de ionização, e menor raio atômico. E os elementos mais eletronegativos é o fluor, oxigênio, nitrogênio, cloro, ...
O oxigênio é o segundo elemento mais eletronegativo. Descartamos a b)
c)
d) Quase todos os elementos do grupo 2 obedecem a regra do octeto(tem execeções: boro e carbono condensado são exemplos). A variação da quantidade de eletrons que pode receber decorre na maioria pelos subniveis d, e no carbono não existe o subnível 2d, então descartamos a letra d)
e) Para termos que seja uma geometria octaédrica, é necessário que haja hibridização sp³d². E isto não ocorre devido à ligações apolares do SiCl4, mas sim ao rearranjo de eletrons na sua ultima camada para formar as ligações.
O silicio só admite, se não me engano, a hibridização sp³. sp³d² seria mais para metais e gases nobres.
____________________________________________
← → ↛  ⇌ ⇔ ⇐ ⇒ ⇏ ➥
⇌ ⇔ ⇐ ⇒ ⇏ ➥
 ⇌ ⇔ ⇐ ⇒ ⇏ ➥
⇌ ⇔ ⇐ ⇒ ⇏ ➥⁰ ¹ ² ³ ⁴ ⁵ ⁶ ⁷ ⁸ ⁹ ⁺ ⁻ ⁼ ⁽ ⁾ º ª ⁿ ⁱ
₀ ₁ ₂ ₃ ₄ ₅ ₆ ₇ ₈ ₉ ₊ ₋ ₌ ₍ ₎ ₐ ₑ ₒ ₓ ₔ
∴ ≈ ≠ ≡ ≢ ≤ ≥ × ± ∓ ∑ ∏ √ ∛ ∜ ∝ ∞
∀ ∃ ∈ ∉ ⊂ ⊄ ⋂ ⋃ ∧ ∨ ℝ ℕ ℚ ℤ ℂ
⊥ ║ ∡ ∠ ∢ ⊿ △ □ ▭ ◊ ○ ∆ ◦ ⊙ ⊗ ◈
Αα Ββ Γγ Δδ Εε Ζζ Ηη Θθ Ιι Κκ Λλ Μμ Νν Ξξ Οο Ππ Ρρ Σσς Ττ Υυ Φφ Χχ Ψψ Ωω ϑ ϒ ϖ ƒ ij ℓ
∫ ∬ ∭ ∳ ∂ ∇
 ℛ ℜ ℰ ℳ ℊ ℒ
ℛ ℜ ℰ ℳ ℊ ℒ
Carlos Adir- Monitor

- Mensagens : 2820
Data de inscrição : 27/08/2014
Idade : 28
Localização : Gurupi - TO - Brasil
 Re: Atomística
Re: Atomística
A letra C é interessante e devemos provar que está certa.
De acordo com o enunciado o átomo de silício deve fazer uma ligação coordenada e fazer 4 ligações sigma, vamos então checar através dos números quânticos, qual hibridização o silício seria capaz de estabelecer para que isso fosse possível:
distribuição eletrônica do silício:
1s2,2s2,2p6,3s2,3p2 (valência: 3s2,3p2)
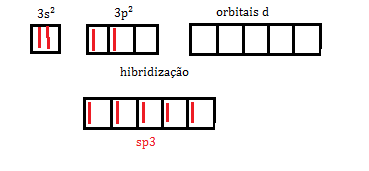
assim, com 4 orbitais desemparelhados o silício faria 4 ligações sigma com o cloro.
Os orbitais d não foram hibridizados, ficaram vazios. A ligação coordenada então seria possível nesses orbitais vazios pois elétrons desemparelhados da molécula de água poderiam ser mutuamente compartilhado pelos dois átomos, verificando a validade da alternativa.
De acordo com o enunciado o átomo de silício deve fazer uma ligação coordenada e fazer 4 ligações sigma, vamos então checar através dos números quânticos, qual hibridização o silício seria capaz de estabelecer para que isso fosse possível:
distribuição eletrônica do silício:
1s2,2s2,2p6,3s2,3p2 (valência: 3s2,3p2)

assim, com 4 orbitais desemparelhados o silício faria 4 ligações sigma com o cloro.
Os orbitais d não foram hibridizados, ficaram vazios. A ligação coordenada então seria possível nesses orbitais vazios pois elétrons desemparelhados da molécula de água poderiam ser mutuamente compartilhado pelos dois átomos, verificando a validade da alternativa.
____________________________________________
Thálisson.

Thálisson C- Monitor

- Mensagens : 3020
Data de inscrição : 19/02/2014
Idade : 27
Localização : Gurupi -TO
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













