Cinética Química 5
3 participantes
Página 1 de 1
 Cinética Química 5
Cinética Química 5
FUVEST-96
Em solução aquosa ocorre a transformação:

Em quatro experimentos, mediu-se o tempo decorrido para formação de mesma concentração de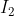 , tendo na mistura de reação as seguintes concentrações iniciais de reagente:
, tendo na mistura de reação as seguintes concentrações iniciais de reagente:

Esses dados indicam que a velocidade da reação considerada depende apenas da concentração de:

Gabarito:
Letra "a"
Em solução aquosa ocorre a transformação:

Em quatro experimentos, mediu-se o tempo decorrido para formação de mesma concentração de

Esses dados indicam que a velocidade da reação considerada depende apenas da concentração de:

Gabarito:
Letra "a"

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 34
Localização : Cuiabá
 Re: Cinética Química 5
Re: Cinética Química 5
Lei da velocidade:
d/T = k.[H2O2]^m.[I^-]^n.[H^+]^p
Nessa questão eu acredito que seja só vc colocar as equações e tentar achar os expoentes. É provável que um dos coeficientes irá zerar, então, só dependerá de outros dois.
d/T = k.[H2O2]^m.[I^-]^n.[H^+]^p
Nessa questão eu acredito que seja só vc colocar as equações e tentar achar os expoentes. É provável que um dos coeficientes irá zerar, então, só dependerá de outros dois.
 Re: Cinética Química 5
Re: Cinética Química 5
O luiseduardo está correto, mas eu desenvolvi a questão desse modo:
A questão deseja que analisemos de forma quantitativa os dados, para que descubramos quais dos reagentes participam realmente do processo no que se trata de velocidade da reação.
Observe que em I o tempo de realização do processo é de 56 segundos.
Em II, quando reduzimos a concentração de H2O2, o tempo aumenta para 87 segundos, o que nos leva a concluir que a concentração de H2O2 está relacionada, de forma direta (quanto maior a concentração, menor o tempo e maior a velocidade), à velocidade de processamento da reação.
Em III, a concentração de H+ reduzida, mas o tempo se mantém inalterado. Isso nos leva a concluir que a concentração de H+ não altera a velocidade de processamento da reação, visto que o tempo também se mantém inalterado.
Em IV, reduz-se a concentração de I-, e o tempo de processamento da reação aumenta para 85 segundos. Isso nos permite concluir que a concentração de I- está relacionada, de forma direta (quanto maior a concentração, menor o tempo e maior a velocidade), à velocidade de processamento da reação.
O item que satisfaz às análises é o item “a”.
Espero ter ajudado. Abraços.
A questão deseja que analisemos de forma quantitativa os dados, para que descubramos quais dos reagentes participam realmente do processo no que se trata de velocidade da reação.
Observe que em I o tempo de realização do processo é de 56 segundos.
Em II, quando reduzimos a concentração de H2O2, o tempo aumenta para 87 segundos, o que nos leva a concluir que a concentração de H2O2 está relacionada, de forma direta (quanto maior a concentração, menor o tempo e maior a velocidade), à velocidade de processamento da reação.
Em III, a concentração de H+ reduzida, mas o tempo se mantém inalterado. Isso nos leva a concluir que a concentração de H+ não altera a velocidade de processamento da reação, visto que o tempo também se mantém inalterado.
Em IV, reduz-se a concentração de I-, e o tempo de processamento da reação aumenta para 85 segundos. Isso nos permite concluir que a concentração de I- está relacionada, de forma direta (quanto maior a concentração, menor o tempo e maior a velocidade), à velocidade de processamento da reação.
O item que satisfaz às análises é o item “a”.
Espero ter ajudado. Abraços.

Heitor Galileu- Iniciante
- Mensagens : 22
Data de inscrição : 09/03/2011
Idade : 28
Localização : Sobral - CE, Brasil
 Re: Cinética Química 5
Re: Cinética Química 5
Obrigado luiseduardo e Heitor Galileu


Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 34
Localização : Cuiabá
 Tópicos semelhantes
Tópicos semelhantes» Cinética Química - Leis integrais da Cinética
» Cinética Química
» cinética química
» Cinética Química - 399 - 4
» Cinética Química
» Cinética Química
» cinética química
» Cinética Química - 399 - 4
» Cinética Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|














