TERMOQUÍMICA (UnB)
3 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 TERMOQUÍMICA (UnB)
TERMOQUÍMICA (UnB)
Boa noite pessoal.. Alguém pode me ajudar?
Na questão abaixo, por que (3) está correta? (conforme o gabarito)
fiz os cálculos e cheguei exatamente nessa resposta ∆H= -2826 kJ.
Alias, obsrvando a reação citada no item seria a inversa daquela que está no enunciado e daí só trocar o sinal. Então essa é a minha dúvida.
(UnB) A energia de ligação é a quantidade de energia necessária para quebrar um mol de uma dada ligação. Então, por energia de ligação entende-se a variação de entalpia, ∆H, usada para romper um mol de ligação. Por exemplo, na reação, a 25°C, representada pela equação:

São quebrados 4 mols de ligações C-H, sendo a energia de ligação, portanto, 416 kJ/mol. Ao passo que na reação:
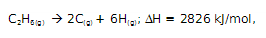
também a 25°C são quebradas as ligações C-H e C-C. Com base nestas informações, julgue os itens.
(1) O valor da energia de ligação C-C, a 25°C é 330kj/mol;
(2) Ambas as reações citadas são exotérmicas;
(3) ∆H = -2826 kJ/mol não corresponde à variação de
entalpia de formação de um mol de C2H6(g),a 25°C;
(4) No processo C2OH6(g) -> 2C(g) + 6H(g) são quebradas
6 ligações C-H e 2 ligações C-C ;
(5) Para romper as ligações de 1/2 mol de C2H6(g) são
necessários 1413 kJ
Obrigada
Na questão abaixo, por que (3) está correta? (conforme o gabarito)
fiz os cálculos e cheguei exatamente nessa resposta ∆H= -2826 kJ.
Alias, obsrvando a reação citada no item seria a inversa daquela que está no enunciado e daí só trocar o sinal. Então essa é a minha dúvida.
(UnB) A energia de ligação é a quantidade de energia necessária para quebrar um mol de uma dada ligação. Então, por energia de ligação entende-se a variação de entalpia, ∆H, usada para romper um mol de ligação. Por exemplo, na reação, a 25°C, representada pela equação:

São quebrados 4 mols de ligações C-H, sendo a energia de ligação, portanto, 416 kJ/mol. Ao passo que na reação:
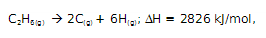
também a 25°C são quebradas as ligações C-H e C-C. Com base nestas informações, julgue os itens.
(1) O valor da energia de ligação C-C, a 25°C é 330kj/mol;
(2) Ambas as reações citadas são exotérmicas;
(3) ∆H = -2826 kJ/mol não corresponde à variação de
entalpia de formação de um mol de C2H6(g),a 25°C;
(4) No processo C2OH6(g) -> 2C(g) + 6H(g) são quebradas
6 ligações C-H e 2 ligações C-C ;
(5) Para romper as ligações de 1/2 mol de C2H6(g) são
necessários 1413 kJ
Obrigada

jeh_sb- Padawan

- Mensagens : 52
Data de inscrição : 25/09/2012
Idade : 32
Localização : sao paulo
 Re: TERMOQUÍMICA (UnB)
Re: TERMOQUÍMICA (UnB)
Não entendi isso também, fui atrás de um gabarito e achei a seguinte justificativa:
Verdadeiro. ΔH = – 2 826 kJ/mol não corresponde à variação de entalpia de formação de um mol de C2H6(g), a 25°C, corresponde à energia para formar todas as ligações de 1 mol de C2H6(g).




Verdadeiro. ΔH = – 2 826 kJ/mol não corresponde à variação de entalpia de formação de um mol de C2H6(g), a 25°C, corresponde à energia para formar todas as ligações de 1 mol de C2H6(g).
ViniciusAlmeida12- Mestre Jedi

- Mensagens : 725
Data de inscrição : 02/02/2013
Idade : 28
Localização : Bahia
 Re: TERMOQUÍMICA (UnB)
Re: TERMOQUÍMICA (UnB)
A justificativa está errada porque entalpia de formação corresponde ao calor liberado ou absorvido na formação de 1 mol da substância, partindo-se das substâncias simples correspondentes no estado-padrão, condição esta que não ocorre na equação inversa. A alternativa estaria correta se estivesse escrito entalpia de formação de ligação.

Hayzel Sh- Estrela Dourada

- Mensagens : 1110
Data de inscrição : 02/04/2016
Idade : 26
Localização : Curitiba, PR
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












