Variações de entropia
3 participantes
PiR2 :: Física :: Termologia
Página 1 de 2
Página 1 de 2 • 1, 2 
 Variações de entropia
Variações de entropia
Suponha que 50,0 g de água em 20ºC são misturados com 65,0 g de água a 50ºC, sob pressão atmosférica constante, em um recipiente termicamente isolado. Calcule a variação de entropia do sistema e a variação de entropia total desse processo.
(Dado: capacidade calorífica molar da água à pressão constante = 75,29 J/K*mol)
Respostas:
Variação de entropia da água quente = -11,07 J/K
Variação de entropia da água fria = +11,85 J/K
Variação de entropia total = +0,78 J/K
(Dado: capacidade calorífica molar da água à pressão constante = 75,29 J/K*mol)
Respostas:
Variação de entropia da água quente = -11,07 J/K
Variação de entropia da água fria = +11,85 J/K
Variação de entropia total = +0,78 J/K
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: Variações de entropia
Re: Variações de entropia
∆S = Q/T
M H2O = 18g/mol
20°C = 293K / 50g = 2,78 mol
50°C = 323K / 65g = 3,61... mol
Cp = 75,29 J/K*mol
2,78*75,29*(θ - 293) + 3,61*75,29*(θ - 323) = 0
209,31θ - 61326,72 + 271,80θ - 87790,40 = 0
481,11θ = 149117,12
θ = 309,94 K
Qf =2,78*75,29*(309,94 - 293) = 3545,65 J
Qq = 3,61*75,29*(309,94 - 323) = - 3545,65 J
∆Sf= 3545,65 / (293+309,94) / 2 = 11,76 J/K
∆Sq= - 3545,65 / (323+309,94) / 2 = -11,20 J/K
∆St = 0,56 J/K
Desculpe pelas aproximações, mas creio que o princípio seja esse.
M H2O = 18g/mol
20°C = 293K / 50g = 2,78 mol
50°C = 323K / 65g = 3,61... mol
Cp = 75,29 J/K*mol
2,78*75,29*(θ - 293) + 3,61*75,29*(θ - 323) = 0
209,31θ - 61326,72 + 271,80θ - 87790,40 = 0
481,11θ = 149117,12
θ = 309,94 K
Qf =2,78*75,29*(309,94 - 293) = 3545,65 J
Qq = 3,61*75,29*(309,94 - 323) = - 3545,65 J
∆Sf= 3545,65 / (293+309,94) / 2 = 11,76 J/K
∆Sq= - 3545,65 / (323+309,94) / 2 = -11,20 J/K
∆St = 0,56 J/K
Desculpe pelas aproximações, mas creio que o princípio seja esse.
edisontostes- Iniciante
- Mensagens : 24
Data de inscrição : 13/04/2012
Idade : 28
Localização : Brasília - DF
 Re: Variações de entropia
Re: Variações de entropia
Muito obrigado, Edisontostes! 
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: Variações de entropia
Re: Variações de entropia
De nada, cara! No que precisar estamos aí! (;
edisontostes- Iniciante
- Mensagens : 24
Data de inscrição : 13/04/2012
Idade : 28
Localização : Brasília - DF
 Re: Variações de entropia
Re: Variações de entropia
Olá pessoal.
Tenho algumas dúvidas (na verdade muitas) a respeito da entropia na termodinâmica, algumas coisas relacionadas ao conceito, fórmula para se calcular a variação, e etc.
Só havia lido em livros didáticos, aquela relação acima, que todo mundo que lê algo sobre entropia vê, que é : ∆S = Q/T
Estava procurando algum exemplo numérico na Internet, relacionado a algum problema de variação de entropia, mas tudo o que vejo é algo relacionado a Cálculo, com uso de integrais e diferenciais, o que é ruim pra mim, pois ainda nem conheço o conceito muito bem.
Estava vendo a resolução acima, e fiquei confuso com vários aspectos da resolução.
Por exemplo, no caso da fonte fria:
A variação da entropia da água fria, por exemplo, foi dado por:
∆S = 2Qf/(Te+Tf)
em que Qf = quantidade de calor recebido desde o estado inicial, até alcançar o equilíbrio térmico
Te = Temperatura de equilíbrio
Tf = Temperatura inicial da fonte fria (da água mais fria)
Fiquei muito intrigado, pois não parece obedecer à fórmula inicial ∆S = Q/T, e ainda me perguntei o porquê multiplicar as entropias por 2.
Depois, não entendi muito bem no final, a variação total da entropia foi dada por:
∆S total = Sf - |Sq|. Porque?
Desculpe, pra alguns pode parecer até uma dúvida um pouco óbvia, mas o problema é que eu não conheço muito bem o conceito. Será que alguém poderia me ajudar aqui, explicando a resolução com base no conceito de entropia ? Obrigado !
Tenho algumas dúvidas (na verdade muitas) a respeito da entropia na termodinâmica, algumas coisas relacionadas ao conceito, fórmula para se calcular a variação, e etc.
Só havia lido em livros didáticos, aquela relação acima, que todo mundo que lê algo sobre entropia vê, que é : ∆S = Q/T
Estava procurando algum exemplo numérico na Internet, relacionado a algum problema de variação de entropia, mas tudo o que vejo é algo relacionado a Cálculo, com uso de integrais e diferenciais, o que é ruim pra mim, pois ainda nem conheço o conceito muito bem.
Estava vendo a resolução acima, e fiquei confuso com vários aspectos da resolução.
Por exemplo, no caso da fonte fria:
A variação da entropia da água fria, por exemplo, foi dado por:
∆S = 2Qf/(Te+Tf)
em que Qf = quantidade de calor recebido desde o estado inicial, até alcançar o equilíbrio térmico
Te = Temperatura de equilíbrio
Tf = Temperatura inicial da fonte fria (da água mais fria)
Fiquei muito intrigado, pois não parece obedecer à fórmula inicial ∆S = Q/T, e ainda me perguntei o porquê multiplicar as entropias por 2.
Depois, não entendi muito bem no final, a variação total da entropia foi dada por:
∆S total = Sf - |Sq|. Porque?
Desculpe, pra alguns pode parecer até uma dúvida um pouco óbvia, mas o problema é que eu não conheço muito bem o conceito. Será que alguém poderia me ajudar aqui, explicando a resolução com base no conceito de entropia ? Obrigado !
Última edição por Thvilaça em Qua 01 Ago 2012, 14:55, editado 1 vez(es)
Thvilaça- Recebeu o sabre de luz

- Mensagens : 148
Data de inscrição : 23/06/2011
Localização : São Paulo - SP
 Re: Variações de entropia
Re: Variações de entropia
Explicarei a resolução passo por passo, assim que possível, bem como abordarei os conceitos necessários.
edisontostes- Iniciante
- Mensagens : 24
Data de inscrição : 13/04/2012
Idade : 28
Localização : Brasília - DF
 Re: Variações de entropia
Re: Variações de entropia
Obrigado, na verdade só não compreendi muito bem os teus cálculos!
Thvilaça- Recebeu o sabre de luz

- Mensagens : 148
Data de inscrição : 23/06/2011
Localização : São Paulo - SP
 Re: Variações de entropia
Re: Variações de entropia
Sendo assim:
Estes são os dados fornecidos pelo exercício:
∆S = Q/T
M H2O = 18g/mol
20°C = 293K / 50g = 2,78 mol
50°C = 323K / 65g = 3,61... mol
Cp = 75,29 J/K*mol
Cálculo da temperatura na qual se dá o equilíbrio térmico:
2,78*75,29*(θ - 293) + 3,61*75,29*(θ - 323) = 0
209,31θ - 61326,72 + 271,80θ - 87790,40 = 0
481,11θ = 149117,12
θ = 309,94 K
Quantidades de calores fornecidas e absorvidas:
Qf =2,78*75,29*(309,94 - 293) = 3545,65 J (absorvida)
Qq = 3,61*75,29*(309,94 - 323) = - 3545,65 J (fornecida)
Cálculo da variação de entropia:
∆S = Q/T, tendo T variação em t, temos: ∆S = Q/média das temperaturas final e inicial.
∆Sf= 3545,65 / [(293+309,94) / 2] = 11,76 J/K
∆Sq= - 3545,65 / [(323+309,94) / 2] = -11,20 J/K
Para determinação da entropia total, somam-se as entropias:
∆St = 0,56 J/K
Qualquer dúvida, eu tento explicar melhor...
Estes são os dados fornecidos pelo exercício:
∆S = Q/T
M H2O = 18g/mol
20°C = 293K / 50g = 2,78 mol
50°C = 323K / 65g = 3,61... mol
Cp = 75,29 J/K*mol
Cálculo da temperatura na qual se dá o equilíbrio térmico:
2,78*75,29*(θ - 293) + 3,61*75,29*(θ - 323) = 0
209,31θ - 61326,72 + 271,80θ - 87790,40 = 0
481,11θ = 149117,12
θ = 309,94 K
Quantidades de calores fornecidas e absorvidas:
Qf =2,78*75,29*(309,94 - 293) = 3545,65 J (absorvida)
Qq = 3,61*75,29*(309,94 - 323) = - 3545,65 J (fornecida)
Cálculo da variação de entropia:
∆S = Q/T, tendo T variação em t, temos: ∆S = Q/média das temperaturas final e inicial.
∆Sf= 3545,65 / [(293+309,94) / 2] = 11,76 J/K
∆Sq= - 3545,65 / [(323+309,94) / 2] = -11,20 J/K
Para determinação da entropia total, somam-se as entropias:
∆St = 0,56 J/K
Qualquer dúvida, eu tento explicar melhor...
edisontostes- Iniciante
- Mensagens : 24
Data de inscrição : 13/04/2012
Idade : 28
Localização : Brasília - DF
 Re: Variações de entropia
Re: Variações de entropia
Quando há variação da temperatura, usa-se mesmo a média aritmética ?
Minha dúvida era essa, quando ocorria a variação de temperatura, como calcular a variação da entalpia ?
Procurei muito sobre o assunto na internet. Aí, uma das únicas formas que eu achei, á pressão constante, seria a seguinte(envolve integral):
∆S =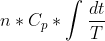
daí, integrando:
∆S =)
Onde T seria a temperatura final(ou de equilíbrio), e Ti a temperatura inicial.
Substituindo os valores do exercício, eu vi que resultou no valor correto, como vc conseguiu usando a média aritmética das temperaturas inicial e final. Por exemplo, para os 50g de água a 20 °C, substituindo os valores :
∆S =*(75,29)*ln(\frac{309,94}{293})) = 11,76 J/K
= 11,76 J/K
Mas se sua forma é sempre correta (como deu aí no exercício), obrigado pela ajuda. Não sabia disso. Minha dúvida era essa mesmo, quando ocorria a variação da temperatura. Até mais!
Minha dúvida era essa, quando ocorria a variação de temperatura, como calcular a variação da entalpia ?
Procurei muito sobre o assunto na internet. Aí, uma das únicas formas que eu achei, á pressão constante, seria a seguinte(envolve integral):
∆S =
daí, integrando:
∆S =
Onde T seria a temperatura final(ou de equilíbrio), e Ti a temperatura inicial.
Substituindo os valores do exercício, eu vi que resultou no valor correto, como vc conseguiu usando a média aritmética das temperaturas inicial e final. Por exemplo, para os 50g de água a 20 °C, substituindo os valores :
∆S =
Mas se sua forma é sempre correta (como deu aí no exercício), obrigado pela ajuda. Não sabia disso. Minha dúvida era essa mesmo, quando ocorria a variação da temperatura. Até mais!
Thvilaça- Recebeu o sabre de luz

- Mensagens : 148
Data de inscrição : 23/06/2011
Localização : São Paulo - SP
 Re: Variações de entropia
Re: Variações de entropia
Bem, aprendi isso vendo resolução de provas e exercícios de ensino médio, e sempre deu certo pra mim.
edisontostes- Iniciante
- Mensagens : 24
Data de inscrição : 13/04/2012
Idade : 28
Localização : Brasília - DF
Página 1 de 2 • 1, 2 
 Tópicos semelhantes
Tópicos semelhantes» variações
» variações
» Gravidade e Variações Climáticas
» VARIAÇÕES DE TEMPERATURA METAL E GELO
» Entropia
» variações
» Gravidade e Variações Climáticas
» VARIAÇÕES DE TEMPERATURA METAL E GELO
» Entropia
PiR2 :: Física :: Termologia
Página 1 de 2
Permissões neste sub-fórum
Não podes responder a tópicos












