EN-2004 Termodinâmica
2 participantes
PiR2 :: Física :: Termologia
Página 1 de 1
 EN-2004 Termodinâmica
EN-2004 Termodinâmica
O recipiente esquematizado na figura abaixo, contém um mol certo gás perfeito, monoatômico, em cada um dos de compartimentos termicamente isolados A e B. A parede isolante interna que os separa é móvel e todo o gás do recipiente estava inicialmente na temperatura de 20,0°C, com a chave S do circuito aberta e a parede interna em equilíbrio estático. Fechando-se a chave S, uma corrente elétrica constante de 1,00A atravessa a resistência elétrica R=20,00, durante 16,0 segundos, após os quais, a chave s é reaberta. Verifica-se então que o gás no compartimento A teve sua temperatura elevada para enquanto a 40,3°C temperatura do gás em B aumentou para 25,0° 10/13 Considerando os fios de ligação, entre o resistor e a bateria, isolados,
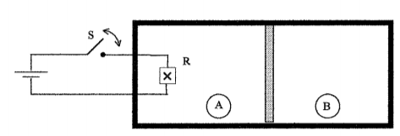
a) calcule a variação percentual de volume (∆V/V) do gás no compartimento A (R: 2,5%)
b) a variação de energia interna do gás contido no recipiente (R:315J)

a) calcule a variação percentual de volume (∆V/V) do gás no compartimento A (R: 2,5%)
b) a variação de energia interna do gás contido no recipiente (R:315J)

Júliawww_520- Jedi

- Mensagens : 423
Data de inscrição : 08/02/2022
Idade : 21
Localização : Rio de Janeiro, RJ
 Re: EN-2004 Termodinâmica
Re: EN-2004 Termodinâmica
Boa noite. Após os dois gases sofrerem um aumento de temperatura, o equilíbrio ocorrerá quando os dois exercerem a mesma pressão sobre a parede móvel. Como os dois recipientes são termicamente isolados, a única possibilidade para mudar a pressão é alterando o volume. Já que o recipiente A esquenta mais, então seu volume aumentará e o de B diminuirá, logo:
[latex]P_{A} = P_B \rightarrow \frac{V + x}{T_A} = \frac{V - x}{T_B} \\
\frac{V + x}{313,3} = \frac{V - x}{298} \rightarrow 15,3V = 611,3x
\therefore \frac{x}{V} = \frac{15,3}{611,3} = 0,0250 = 2,5 % [/latex]
A energia interna depende apenas da temperatura, portanto:
[latex] \Delta U _A= nC_v \Delta T _A = 1.\frac{3R}{2}.(40,3 - 20) = 253,04J \\
\Delta U _B= nC_v \Delta T _B=1. \frac{3R}{2}.(25 - 20)=62,3 J \\
\Delta U _{total} = 253,04 + 62,3 = 315,34 J [/latex]
[latex]P_{A} = P_B \rightarrow \frac{V + x}{T_A} = \frac{V - x}{T_B} \\
\frac{V + x}{313,3} = \frac{V - x}{298} \rightarrow 15,3V = 611,3x
\therefore \frac{x}{V} = \frac{15,3}{611,3} = 0,0250 = 2,5 % [/latex]
A energia interna depende apenas da temperatura, portanto:
[latex] \Delta U _A= nC_v \Delta T _A = 1.\frac{3R}{2}.(40,3 - 20) = 253,04J \\
\Delta U _B= nC_v \Delta T _B=1. \frac{3R}{2}.(25 - 20)=62,3 J \\
\Delta U _{total} = 253,04 + 62,3 = 315,34 J [/latex]
Última edição por Leonardo Mariano em Sex 15 Mar 2024, 21:24, editado 1 vez(es) (Motivo da edição : Tinha colocado valores errados no item A)

Leonardo Mariano- Monitor

- Mensagens : 647
Data de inscrição : 11/11/2018
Idade : 22
Localização : Criciúma/SC
Júliawww_520 gosta desta mensagem
 Re: EN-2004 Termodinâmica
Re: EN-2004 Termodinâmica
A energia interna depende apenas da temperatura, portanto:
[latex] \Delta U _A= nC_v \Delta T _A = 1.\frac{3R}{2}.(40,3 - 20) = 253,04J \\
\Delta U _B= nC_v \Delta T _B=1. \frac{3R}{2}.(25 - 20)=62,3 J \\
\Delta U _{total} = 253,04 + 62,3 = 315,34 J [/latex][/quote]
Não entendi essa parte final. Você substituiu a constante R por qual valor?

Júliawww_520- Jedi

- Mensagens : 423
Data de inscrição : 08/02/2022
Idade : 21
Localização : Rio de Janeiro, RJ
Leonardo Mariano gosta desta mensagem
 Re: EN-2004 Termodinâmica
Re: EN-2004 Termodinâmica
A variação da energia interna de um gás ideal é dada por [latex] nC_v\Delta T [/latex], em que Cv é o calor específico do gás a volume constante. Para gases monoatômicos, que é o caso da questão, Cv vale 3R/2. Esses valores são provenientes do princípio da equipartição de energia.
Como estamos trabalhando no SI, utilizei R = 8,31 J/(mol.K), que é o seu valor tabelado, então encontrei a variação de cada gás e somei para obter o total.
Como estamos trabalhando no SI, utilizei R = 8,31 J/(mol.K), que é o seu valor tabelado, então encontrei a variação de cada gás e somei para obter o total.

Leonardo Mariano- Monitor

- Mensagens : 647
Data de inscrição : 11/11/2018
Idade : 22
Localização : Criciúma/SC
 Re: EN-2004 Termodinâmica
Re: EN-2004 Termodinâmica
Leonardo Mariano escreveu:A variação da energia interna de um gás ideal é dada por [latex] nC_v\Delta T [/latex], em que Cv é o calor específico do gás a volume constante. Para gases monoatômicos, que é o caso da questão, Cv vale 3R/2. Esses valores são provenientes do princípio da equipartição de energia.
Como estamos trabalhando no SI, utilizei R = 8,31 J/(mol.K), que é o seu valor tabelado, então encontrei a variação de cada gás e somei para obter o total.
Ah, entendi. Obrigada!

Júliawww_520- Jedi

- Mensagens : 423
Data de inscrição : 08/02/2022
Idade : 21
Localização : Rio de Janeiro, RJ
Leonardo Mariano gosta desta mensagem
PiR2 :: Física :: Termologia
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












