Modelo de Bohr
2 participantes
PiR2 :: Física :: Física Moderna
Página 1 de 1
 Modelo de Bohr
Modelo de Bohr
De onde vem a ideia da quantização do momento angular de Bohr?
Foi algo imposto sem qualquer justificativa?
A quantização dos níveis de energia tenta explicar a estabilidade do átomo, mas...
Foi algo imposto sem qualquer justificativa?
A quantização dos níveis de energia tenta explicar a estabilidade do átomo, mas...
Convidado- Convidado
 Re: Modelo de Bohr
Re: Modelo de Bohr
O modelo de Bohr tem como base a física a quântica.
Esta parte da física foi iniciada por Max Planck, ou seja , Bohr conhecia os trabalhos desenvolvidos por Planck.
Ele de certa forma sábia que no mundo das particulas subatomicas se estabestabelecia o comportamento quântico, isto é,as particulas se comportavam de maneira diferente em relação ao descrito pela a física clássica .
Esta parte da física foi iniciada por Max Planck, ou seja , Bohr conhecia os trabalhos desenvolvidos por Planck.
Ele de certa forma sábia que no mundo das particulas subatomicas se estabestabelecia o comportamento quântico, isto é,as particulas se comportavam de maneira diferente em relação ao descrito pela a física clássica .

Emersonsouza- Fera

- Mensagens : 1100
Data de inscrição : 14/01/2015
Idade : 28
Localização : Rio de Janeiro
 Re: Modelo de Bohr
Re: Modelo de Bohr
Emerson,
não querendo ser grosso, mas sua resposta não me incrementou em nada.
Aliás, pelo o que sei, Planck se referia à energia quantizada, não momento angular quantizado (que é a minha pergunta).
não querendo ser grosso, mas sua resposta não me incrementou em nada.
Aliás, pelo o que sei, Planck se referia à energia quantizada, não momento angular quantizado (que é a minha pergunta).
Convidado- Convidado
 Re: Modelo de Bohr
Re: Modelo de Bohr
Olá RioBrancoabc.
Até onde sei, Bohr iniciou seus trabalhos através da quantização de energia, ou seja, o tal ponta pé inicial dado por Planck no estudo do corpo negro:
 .
.
Admitiu, inicialmente, que o sistema próton-elétron do átomo de Hidrogênio obedece as leis da mecânica clássica (hoje sabemos que isso está incorreto). Assim, o elétron descrevia, para Bohr, uma órbita circular em torno do próton, centro da circunferência. Segundo a mecânica clássica, em órbitas com essa geometria, atua a força centrípeta, nesse caso quem faz o seu papel é a força de atração elétrica, a famosa lei de Coulomb.
(Não trabalharei com massa reduzida)
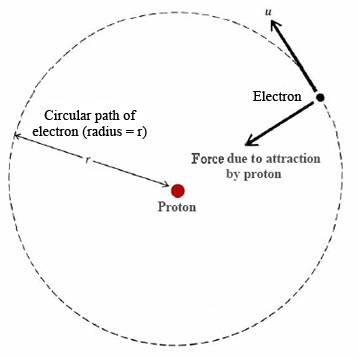
(Fonte: Link)
Sejam m a massa do elétron, e a carga fundamental, k a cte eletrostática, v a velocidade do elétron e r o raio da trajetória.


 ... (*)
... (*)
Podemos avaliar o problema sob a ótica da energia. A energia "total" é dada por
 .
.
Aplicando a relação *, descobrimos que E pode ser escrita em função apenas da velocidade e da massa do elétron.

Recorrendo mais uma vez à relação *, notemos que multiplicando os dois membros por r obtemos

e sendo o momento angular, descobrimos que
o momento angular, descobrimos que
 ... (**)
... (**)
Substituindo ** na equação da energia, ficamos com
 .
.
Na transição do elétron de um nível de energia para outro, Bohr assumiu a quantização da energia primeiramente estudada por Planck, como já foi explicado. Estudando tal transição, pela equação da energia, o fator que deve ser alterado entre dois níveis é o momento angular L. Vejamos...

A diferença entre E1 e E2 é, como você deve saber, muito pequena, no geral (mas não nula!). Assim, é natural admitir a aproximação . Note que fazendo isso, continua incorreto dizer que
. Note que fazendo isso, continua incorreto dizer que  , pois os valores são próximos, não iguais. Nesse caso, chamando a diferença acima de
, pois os valores são próximos, não iguais. Nesse caso, chamando a diferença acima de  , a diferença entre os dois níveis de energia fica
, a diferença entre os dois níveis de energia fica


Aplicando * e lembrando que L = mvr, ficamos com:



O resultado acima mostra que, partindo-se da quantização da energia e admitindo que a mecânica clássica serve para descrever o comportamento do átomo de hidrogênio, é possível demonstrar a quantização do momento angular. Apenas complementando, é natural dizer que (seria o centro da circunferência?), o que nos faz concluir que L é um múltiplo inteiro da constante reduzida de Planck:
(seria o centro da circunferência?), o que nos faz concluir que L é um múltiplo inteiro da constante reduzida de Planck:

Até onde sei, Bohr iniciou seus trabalhos através da quantização de energia, ou seja, o tal ponta pé inicial dado por Planck no estudo do corpo negro:
 .
.Admitiu, inicialmente, que o sistema próton-elétron do átomo de Hidrogênio obedece as leis da mecânica clássica (hoje sabemos que isso está incorreto). Assim, o elétron descrevia, para Bohr, uma órbita circular em torno do próton, centro da circunferência. Segundo a mecânica clássica, em órbitas com essa geometria, atua a força centrípeta, nesse caso quem faz o seu papel é a força de atração elétrica, a famosa lei de Coulomb.
(Não trabalharei com massa reduzida)

(Fonte: Link)
Sejam m a massa do elétron, e a carga fundamental, k a cte eletrostática, v a velocidade do elétron e r o raio da trajetória.


 ... (*)
... (*)Podemos avaliar o problema sob a ótica da energia. A energia "total" é dada por
 .
.Aplicando a relação *, descobrimos que E pode ser escrita em função apenas da velocidade e da massa do elétron.

Recorrendo mais uma vez à relação *, notemos que multiplicando os dois membros por r obtemos

e sendo
 o momento angular, descobrimos que
o momento angular, descobrimos que ... (**)
... (**)Substituindo ** na equação da energia, ficamos com
 .
.Na transição do elétron de um nível de energia para outro, Bohr assumiu a quantização da energia primeiramente estudada por Planck, como já foi explicado. Estudando tal transição, pela equação da energia, o fator que deve ser alterado entre dois níveis é o momento angular L. Vejamos...

A diferença entre E1 e E2 é, como você deve saber, muito pequena, no geral (mas não nula!). Assim, é natural admitir a aproximação
 . Note que fazendo isso, continua incorreto dizer que
. Note que fazendo isso, continua incorreto dizer que  , pois os valores são próximos, não iguais. Nesse caso, chamando a diferença acima de
, pois os valores são próximos, não iguais. Nesse caso, chamando a diferença acima de  , a diferença entre os dois níveis de energia fica
, a diferença entre os dois níveis de energia fica

Aplicando * e lembrando que L = mvr, ficamos com:



O resultado acima mostra que, partindo-se da quantização da energia e admitindo que a mecânica clássica serve para descrever o comportamento do átomo de hidrogênio, é possível demonstrar a quantização do momento angular. Apenas complementando, é natural dizer que
 (seria o centro da circunferência?), o que nos faz concluir que L é um múltiplo inteiro da constante reduzida de Planck:
(seria o centro da circunferência?), o que nos faz concluir que L é um múltiplo inteiro da constante reduzida de Planck:
gilberto97- Fera

- Mensagens : 590
Data de inscrição : 12/03/2014
Idade : 27
Localização : São Luís, Maranhão, Brasil
 Re: Modelo de Bohr
Re: Modelo de Bohr
Cheguei no mesmo por De Broglie, levando em conta que 2hraio/comp deve ser inteiro.
Convidado- Convidado
 Re: Modelo de Bohr
Re: Modelo de Bohr
Essa demonstração também é válida. Acontece que o trabalho de De Broglie veio após o de Bohr, então quando você perguntou se foi algo imposto sem nenhuma justificativa, busquei dar uma fidelidade histórica à minha resposta.

gilberto97- Fera

- Mensagens : 590
Data de inscrição : 12/03/2014
Idade : 27
Localização : São Luís, Maranhão, Brasil
PiR2 :: Física :: Física Moderna
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos












