Fração Molar e Porcentagem em Massa
4 participantes
Página 1 de 1
 Fração Molar e Porcentagem em Massa
Fração Molar e Porcentagem em Massa
Uma mistura gasosa possui :

em volume.
a) Determine a fração molar de cada componente.
b) Qual é a massa molecular média da mistura?
c)Quais são as porcentagens em massa de cada substância?
Gabarito
a)0,64 e 0,36
b) 24,6g/mol
c)41,6% e 58,4%
Tem um exercício parecido no spoiler:

Porém o item "a" não bate é o item "c" não sei fazer.

em volume.
a) Determine a fração molar de cada componente.
b) Qual é a massa molecular média da mistura?
c)Quais são as porcentagens em massa de cada substância?
Gabarito
a)0,64 e 0,36
b) 24,6g/mol
c)41,6% e 58,4%
Tem um exercício parecido no spoiler:
- Spoiler:
Um balão de 5 L possui uma mistura de:
sendo que as porcentagens estão em massa. Determine:
a) As frações molares.
b) Os volumes parciais.
Gabarito:
O Luís resolveu assim:
Usando a fórmula n = m / MM
nO2 = 64 / 32 = 2 mol
nCH4 = 32 / 16 = 2 mol
nHe = 4 / 4 = 1 mol
XO2 = 2 / 2 + 2 + 1 = 2 / 5 = 0,4
XCH4 = 2 / 2 + 2 + 1 = 2 / 5 = 0,4
XHe = 1 / 2 + 2 + 1 = 1 / 5 = 0,2
Pelo princípio de Avogadro, "iguais volumes de quaisquer gases encerram o mesmo número de moléculas, quando medidos nas mesmas condições de temperatura e pressão", temos pela proporção: 2 L de O2, 2 L de CH4 e 1 L de He.

Porém o item "a" não bate é o item "c" não sei fazer.

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: Fração Molar e Porcentagem em Massa
Re: Fração Molar e Porcentagem em Massa
E aí, meu amigo
é o seguinte balanar, la na spoiler as porcentagens eram em massa entao ficava tipo
![\frac{64g O_{2}}{100g [mistura]}](http://latex.codecogs.com/gif.latex?\frac{64g O_{2}}{100g [mistura]})
![\frac{32g CH_{4}_{}}{100g [mistura]}](http://latex.codecogs.com/gif.latex?\frac{32g CH_{4}_{}}{100g [mistura]})
Aí o Luís converteu a massa de cada composto presente em numero de mols, pra aí depois poder calcular a fração molar.
a fração molar pode ser expressa de 3 formas, a saber:
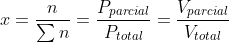
Dessa vez a porcentagem que ele deu é em volumes
Na atual questão, a gente pode dizer que há
CH_{4}}{100(v)mistura})
C_{3}H_{4}}{100(v)mistura})
acho que por isso que dá 0,64volumes e 0,36 volumes
será que não é isso?
a letra c eu não consegui também.
ps:corrigi numa edição aqui, balanar. A fração molar é uma grandeza adimensional. Te peço desculpas, posso ter causado confusão.
é o seguinte balanar, la na spoiler as porcentagens eram em massa entao ficava tipo
Aí o Luís converteu a massa de cada composto presente em numero de mols, pra aí depois poder calcular a fração molar.
a fração molar pode ser expressa de 3 formas, a saber:
Dessa vez a porcentagem que ele deu é em volumes
Na atual questão, a gente pode dizer que há
acho que por isso que dá 0,64
será que não é isso?
a letra c eu não consegui também.
ps:corrigi numa edição aqui, balanar. A fração molar é uma grandeza adimensional. Te peço desculpas, posso ter causado confusão.
Última edição por velloso em Dom 10 Abr 2011, 19:20, editado 1 vez(es)

velloso- Estrela Dourada

- Mensagens : 1142
Data de inscrição : 07/04/2010
Idade : 34
Localização : Belém - Pará
 Re: Fração Molar e Porcentagem em Massa
Re: Fração Molar e Porcentagem em Massa
Show de bola sua resposta velloso

Vamos esperar o Luís e a galera do fórum pra ajudarem na letra "c".
Vamos esperar o Luís e a galera do fórum pra ajudarem na letra "c".

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: Fração Molar e Porcentagem em Massa
Re: Fração Molar e Porcentagem em Massa
Balanar, a porcentagem em massa, ou TÍTULO, é calculada de forma bem parecida da fração molar. Só que em vez de mol é a massa que está em jogo.
Então, primeiro a gente acha a massa e depois calcula o título. Lembrando que 1 mol de volume, nas CNTP, equivale a 22,4 L.
16 g de CH4 ------- 22,4 L
X ----------------- 0,064 L
X = 0,0457 g de CH4
40 g de C3H4 ------- 22,4 L
Y ------------------ 0,036 L
Y = 0,0643 g de C3H4
Agora é só calcular o título (T) -> lembrando que depois que a gente achar o número devemos multiplicar por 100 porque é porcentagem:
T(CH4) = 0,0457 / 0,0457 + 0,0643 = 0,0457 / 0,11 = 0,415 .100 = 41,54%
T(C3H4) = 0,0643 / 0,0457 + 0,0643 = 0,0643 / 0,11 = 0,584 . 100 = 58,4%
Balanar, como se usa spoiler? Eu queria colocar uns exercícios pra ti de vez em quando, mas não queria que o gabarito aparecesse sem antes você tentar resolver. Que daí perde a graça.
Então, primeiro a gente acha a massa e depois calcula o título. Lembrando que 1 mol de volume, nas CNTP, equivale a 22,4 L.
16 g de CH4 ------- 22,4 L
X ----------------- 0,064 L
X = 0,0457 g de CH4
40 g de C3H4 ------- 22,4 L
Y ------------------ 0,036 L
Y = 0,0643 g de C3H4
Agora é só calcular o título (T) -> lembrando que depois que a gente achar o número devemos multiplicar por 100 porque é porcentagem:
T(CH4) = 0,0457 / 0,0457 + 0,0643 = 0,0457 / 0,11 = 0,415 .100 = 41,54%
T(C3H4) = 0,0643 / 0,0457 + 0,0643 = 0,0643 / 0,11 = 0,584 . 100 = 58,4%
Balanar, como se usa spoiler? Eu queria colocar uns exercícios pra ti de vez em quando, mas não queria que o gabarito aparecesse sem antes você tentar resolver. Que daí perde a graça.
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: Fração Molar e Porcentagem em Massa
Re: Fração Molar e Porcentagem em Massa
Show Luís, vlw.

Quando for mandar uma msg clica em "outros" logo em seguida aparece isso:

Depois so clicar em spoiler
Quando for mandar uma msg clica em "outros" logo em seguida aparece isso:

Depois so clicar em spoiler

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Re: Fração Molar e Porcentagem em Massa
Re: Fração Molar e Porcentagem em Massa
Ok, vou tentar ver se dá certo.
Aí vai o exercício, bem esclarecedor sobre porcentagem em volume. Se você conseguir resolvê-lo, então pegou bem o esquema:
O rótulo de um produto usado como desinfetante apresenta, entre outras, a seguinte informação: "cada 100 mL de desinfetante contêm 10 mL de solução de formaldeído 37% V/V (volume de formaldeído por volume de solução)". A concentração de formaldeído no desinfetante, em porcentagem volume por volume, é:
a) 1,0%
b) 3,7%
c) 10%
d) 37%
Aí vai o exercício, bem esclarecedor sobre porcentagem em volume. Se você conseguir resolvê-lo, então pegou bem o esquema:
O rótulo de um produto usado como desinfetante apresenta, entre outras, a seguinte informação: "cada 100 mL de desinfetante contêm 10 mL de solução de formaldeído 37% V/V (volume de formaldeído por volume de solução)". A concentração de formaldeído no desinfetante, em porcentagem volume por volume, é:
a) 1,0%
b) 3,7%
c) 10%
d) 37%
- Spoiler:
- Gabarito: B
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: Fração Molar e Porcentagem em Massa
Re: Fração Molar e Porcentagem em Massa
Seria assim ?
Luís, só queria lembrar que o regulamento do fórum não permite duas questões no mesmo tópico. Se quiser postar uma questão para que os outros membros resolvam, basta criar um novo tópico.
Abraço.
- Spoiler:
- "100 mL de desinfetante contêm 10 mL de 37 % V/v"
10*37/100 = 3,7 mL
Então,
3,7 ml/100 ml = 3,7 %
Luís, só queria lembrar que o regulamento do fórum não permite duas questões no mesmo tópico. Se quiser postar uma questão para que os outros membros resolvam, basta criar um novo tópico.
Abraço.
 Re: Fração Molar e Porcentagem em Massa
Re: Fração Molar e Porcentagem em Massa
Ah, eu não sabia disso. Desculpas!! 
É que na verdade é uma espécie de extensão da pergunta do Balanar, já que é pra ver se ele entendeu o assunto. Mas eu entendi, não faço mais isso.
É que na verdade é uma espécie de extensão da pergunta do Balanar, já que é pra ver se ele entendeu o assunto. Mas eu entendi, não faço mais isso.
Luís- Estrela Dourada

- Mensagens : 1177
Data de inscrição : 09/02/2011
 Re: Fração Molar e Porcentagem em Massa
Re: Fração Molar e Porcentagem em Massa
Luís eu esqueci que não podia mais de uma pergunta por tópico rsrsr. Mas valeu a intenção =D.
Com relação ao exercício tenho que praticar mais ausdhasduasda.
:bounce:
Com relação ao exercício tenho que praticar mais ausdhasduasda.
:bounce:

Adam Zunoeta- Monitor

- Mensagens : 4223
Data de inscrição : 25/08/2010
Idade : 35
Localização : Cuiabá
 Tópicos semelhantes
Tópicos semelhantes» Fração molar, massa molar, propriedades coligativas
» Fração Molar
» Fração molar
» Fração molar de misturas
» frAÇAO MOLAR
» Fração Molar
» Fração molar
» Fração molar de misturas
» frAÇAO MOLAR
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













