Entalpia da formação
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Entalpia da formação
Entalpia da formação
Dê a Entalpia da formação do Fosgênio
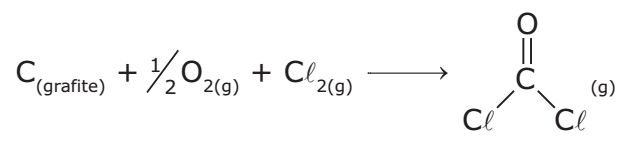
C = O, energia de ligação (kJ.mol-1) = 804
C = Cl, energia de ligação (kJ.mol-1) = 346
O = O, energia de ligação (kJ.mol-1) = 498
Cl - Cl, energia de ligação (kJ.mol-1) = 243
Minha resolução e interpretação. O que estou errando quanto a interpretação?
H = Hp-Hr = 1496-492 = 1004
Interpretação: Por ser reação de formação de ligações variação de entalpia é exotérmica, logo:
Entalpia de formação = -1004kJ.mol-1
A resposta é -1004kJ.mol-1, logo minha resposta está certa, mas não entendo se estou calculando corretamente.
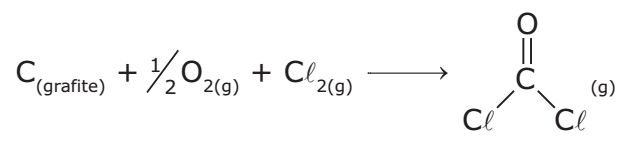
C = O, energia de ligação (kJ.mol-1) = 804
C = Cl, energia de ligação (kJ.mol-1) = 346
O = O, energia de ligação (kJ.mol-1) = 498
Cl - Cl, energia de ligação (kJ.mol-1) = 243
Minha resolução e interpretação. O que estou errando quanto a interpretação?
H = Hp-Hr = 1496-492 = 1004
Interpretação: Por ser reação de formação de ligações variação de entalpia é exotérmica, logo:
Entalpia de formação = -1004kJ.mol-1
A resposta é -1004kJ.mol-1, logo minha resposta está certa, mas não entendo se estou calculando corretamente.

Diego A- Monitor

- Mensagens : 1398
Data de inscrição : 20/04/2016
Idade : 28
Localização : Cascavel - PR
 Re: Entalpia da formação
Re: Entalpia da formação
Christian,
2∆Hf = 0*2 + 498*1 + 2*243 - (804*2 + 346*4) = -2008 kJ.mol-1
Deste modo, você não estaria fazendo Hr-Hp ? Por quê?
Foi o que entendi da sua equação

Diego A- Monitor

- Mensagens : 1398
Data de inscrição : 20/04/2016
Idade : 28
Localização : Cascavel - PR
 Re: Entalpia da formação
Re: Entalpia da formação
Para quebrar uma molécula você fornece energia ao sistema (entalpia positiva); para formar uma molécula você retira energia do sistema (entalpia negativa):
HR + HP = ∆H
HR + HP = ∆H
 Tópicos semelhantes
Tópicos semelhantes» Entalpia de formaçao x Entalpia ligaçao
» Entalpia de formação
» entalpia de formação
» Entalpia de formação
» Entalpia de formação
» Entalpia de formação
» entalpia de formação
» Entalpia de formação
» Entalpia de formação
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos













