UPE 2017
2 participantes
PiR2 :: Química :: Química Orgânica
Página 1 de 1
 UPE 2017
UPE 2017
9,5 ml de ter-butanol foi adicionado em um funil de separação de 250 ml, para o qual foram transferidos 28 ml de ácido clorídrico concentrado. O funil permaneceu aberto e houve liberação de vapore. Após a saída dos vapores, o funil foi tampado, e a mistura agitada cuidadosamente, por 20 minutos. De tempos em tempos, a torneira era aberta para liberar os vapores formados e diminuir a pressão dentro do funil. A mistura adquiriu duas fases, uma ácida, transparente, e a outra orgânica, levemente turva. Após a separação das fases, a fase inferior (ácida) foi descartada e a outra foi lavada com solução de bicarbonato de sódio 5% e, em seguida, com água destilada. O produto foi seco com cloreto de cálcio anidro, fazendo a solução ficar transparente. O agente secante foi eliminado por filtração, e o líquido, recolhido para uma vidraria volumétrica.
Qual é o produto dessa reação?
a) butanal
b) 2-metilcetona
c) ácido butanoico
d) ácido terc-butanoico
e) cloreto de terc-butila
Qual é o produto dessa reação?
a) butanal
b) 2-metilcetona
c) ácido butanoico
d) ácido terc-butanoico
e) cloreto de terc-butila

jmm22_- Iniciante
- Mensagens : 27
Data de inscrição : 13/09/2021
 Re: UPE 2017
Re: UPE 2017
Fala, Jm.
Essa reação é exatamente o método de obtenção do cloreto de terc-butila. Ele já é produzido logo na primeira reação do álcool com o HCl, as reações subsequentes servem apenas para purificar ainda mais nosso produto.

Já temos como resposta a letra E, mas vou comentar a necessidade das outras etapas.
Repare que foi adicionado bem mais HCl do que a proporção estequiométrica, assim no funil haverá a superposição de duas fases:

Como há essa separação em fases, basta abrir o funil e escoar o HCl, no entanto sempre sobra um pouco de HCl no funil. Para contornar esse problema e aumentar a pureza do produto, jogamos um pouco de NaHCO3 que reage com os traços do HCl na solução:
[latex]HCl + NaHCO_3 -> NaCl + H_2CO_3 -> NaCl + CO_2 + H_2O[/latex]
O gás carbônico já sai da solução por ser um gás, dai é so jogar água para solubilizar o NaCl e deixar um tempo a mistura decantando:
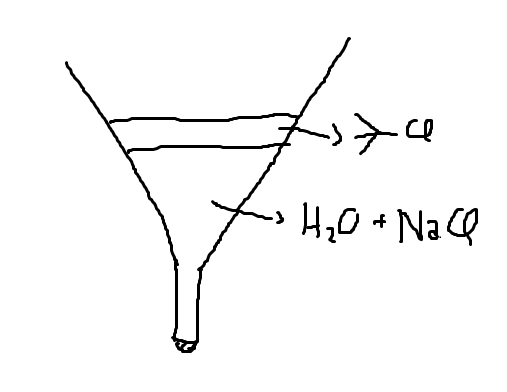
Abrindo o funil mais uma vez para separar a mistura, temos agora que nos livrar dos traços de água que podem restar no funil. Para isso botamos nossa nova mistura em um béquer e adicionamos um agente secante que, nesse caso, é o CaCl2.
Como a quantidade de água é muito pequena, há a formação de pequenas bolas de CaCl2 hidratado, o que segue a seguinte reação:
[latex]CaCl_2 + 6H_2O -> CaCl_2.6H_2O[/latex]
Essas bolinhas são retiradas facilmente por filtração, sobrando assim nosso líquido puro de cloreto de terc-butila.
Essa reação é exatamente o método de obtenção do cloreto de terc-butila. Ele já é produzido logo na primeira reação do álcool com o HCl, as reações subsequentes servem apenas para purificar ainda mais nosso produto.

Já temos como resposta a letra E, mas vou comentar a necessidade das outras etapas.
Repare que foi adicionado bem mais HCl do que a proporção estequiométrica, assim no funil haverá a superposição de duas fases:

Como há essa separação em fases, basta abrir o funil e escoar o HCl, no entanto sempre sobra um pouco de HCl no funil. Para contornar esse problema e aumentar a pureza do produto, jogamos um pouco de NaHCO3 que reage com os traços do HCl na solução:
[latex]HCl + NaHCO_3 -> NaCl + H_2CO_3 -> NaCl + CO_2 + H_2O[/latex]
O gás carbônico já sai da solução por ser um gás, dai é so jogar água para solubilizar o NaCl e deixar um tempo a mistura decantando:

Abrindo o funil mais uma vez para separar a mistura, temos agora que nos livrar dos traços de água que podem restar no funil. Para isso botamos nossa nova mistura em um béquer e adicionamos um agente secante que, nesse caso, é o CaCl2.
Como a quantidade de água é muito pequena, há a formação de pequenas bolas de CaCl2 hidratado, o que segue a seguinte reação:
[latex]CaCl_2 + 6H_2O -> CaCl_2.6H_2O[/latex]
Essas bolinhas são retiradas facilmente por filtração, sobrando assim nosso líquido puro de cloreto de terc-butila.
João Pedro Lima- Jedi

- Mensagens : 218
Data de inscrição : 02/01/2022
Idade : 21
Localização : Rio de Janeiro, RJ
PiR2 :: Química :: Química Orgânica
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













