Ligações Químicas.
3 participantes
Página 1 de 1
 Ligações Químicas.
Ligações Químicas.
O diagrama de van Arkel-Ketelar apresenta uma visão integrada das ligações químicas de compostos binários, representando os três tipos clássicos de ligação nos vértices de um triângulo. Os vértices esquerdo e direito da base correspondem, respectivamente, aos elementos menos e mais eletronegativos, enquanto o vértice superior do triângulo representa o composto puramente iônico. Com base no diagrama, assinale a opção que apresenta o composto binário de maior caráter covalente.
a) CCl4
b) C3N4
c) CO2
d) NO
e) OF2

Eduardo Rabelo- Fera

- Mensagens : 638
Data de inscrição : 23/06/2020
Idade : 19
Localização : Curitiba
 Re: Ligações Químicas.
Re: Ligações Químicas.
Opa Eduardo!
Bom dia colega! Vamos lá:
Seguinte, quando falamos de compostos covalentes, estamos falando de elementos químicos que têm como principal objetivo, atrair elétrons. Logo, compostos químicos covalentes são ótimos exemplos da teoria da eletronegatividade!
Portanto, se nós observarmos os compostos das alternativas, o único que se encaixa no diagrama de van Arkel-Keletar é o Difluoreto de Oxigênio. Mas pq?
Pois, o Flúor(F) é o elemento mais eletronegativo da tabela, seguido do oxigênio. Logo, nesse composto ai, o flúor vence a guerra de atrair elétrons, apesar do oxigênio resistir muito. Portanto, é por isso que o gráfico apresenta este formato, pois não só os elementos flúor e oxigênio são muito eletronegativos, mas também o difluoreto de oxigênio além de ser muito eletronegativo, em determinadas situações, pode ser instável, devido a sua grande capacidade de atrair elétrons.
Um exemplo disso, que posso te passar, é o Difluoreto de Xenônio, um composto raríssimo, envolvendo flúor(composto mais eletronegativo da tabela periódica) e o xenônio(um gás nobre). Para vc ver a força do flúor, ele consegue formar compostos químicos com o xenônio, mesmo que por um curto período de tempo.
Espero ter te ajudado! Qualquer dúvida, poste! Abraços!
Bom dia colega! Vamos lá:
Seguinte, quando falamos de compostos covalentes, estamos falando de elementos químicos que têm como principal objetivo, atrair elétrons. Logo, compostos químicos covalentes são ótimos exemplos da teoria da eletronegatividade!
Portanto, se nós observarmos os compostos das alternativas, o único que se encaixa no diagrama de van Arkel-Keletar é o Difluoreto de Oxigênio. Mas pq?
Pois, o Flúor(F) é o elemento mais eletronegativo da tabela, seguido do oxigênio. Logo, nesse composto ai, o flúor vence a guerra de atrair elétrons, apesar do oxigênio resistir muito. Portanto, é por isso que o gráfico apresenta este formato, pois não só os elementos flúor e oxigênio são muito eletronegativos, mas também o difluoreto de oxigênio além de ser muito eletronegativo, em determinadas situações, pode ser instável, devido a sua grande capacidade de atrair elétrons.
Um exemplo disso, que posso te passar, é o Difluoreto de Xenônio, um composto raríssimo, envolvendo flúor(composto mais eletronegativo da tabela periódica) e o xenônio(um gás nobre). Para vc ver a força do flúor, ele consegue formar compostos químicos com o xenônio, mesmo que por um curto período de tempo.
Espero ter te ajudado! Qualquer dúvida, poste! Abraços!

BatataLaranja345- Mestre Jedi

- Mensagens : 669
Data de inscrição : 09/07/2020
Idade : 19
Localização : Rio de Janeiro
Eduardo Rabelo gosta desta mensagem
 Re: Ligações Químicas.
Re: Ligações Químicas.
Batata, entendi isto. Mas, por que ao usar uma tabela de eletronegatividade a resposta não se mantém?
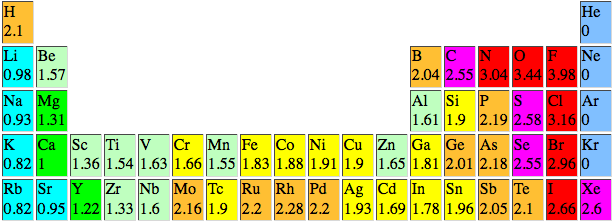
Observando a tabela abaixo, ao fazermos a diferença de eletronegatividade entre o flúor e o oxigênio, encontra-se 0,54. Já, ao fazermos a diferença entre o oxigênio e o nitrôgenio, encontra-se 0,4. Ou seja, mesmo tendo maior diferença de eletronegatividade o OF2 tem caráter mais covalente que o NO?
Observando a tabela abaixo, ao fazermos a diferença de eletronegatividade entre o flúor e o oxigênio, encontra-se 0,54. Já, ao fazermos a diferença entre o oxigênio e o nitrôgenio, encontra-se 0,4. Ou seja, mesmo tendo maior diferença de eletronegatividade o OF2 tem caráter mais covalente que o NO?

Eduardo Rabelo- Fera

- Mensagens : 638
Data de inscrição : 23/06/2020
Idade : 19
Localização : Curitiba
BatataLaranja345 gosta desta mensagem
 Re: Ligações Químicas.
Re: Ligações Químicas.
Eu diria a vc Eduardo que sim!
Pois, lembre-se daquela teoria lá dos compostos covalentes: os elementos compartilham os elétrons, só que há casos onde um elétron ficará mais perto do elemento X do que do Y. Isso ocorre devido a diferença de eletronegatividade entre eles. Até pq, se temos uma diferença de eletronegatividade maior, significa que eles teriam uma disputa maior.
E no caso do NO, tem uma diferença maior, logo, a disputa entre eles é menor... então o caráter covalente dele seria menor do que o do OF2. Eu te digo um conselho, lembre-se que na teoria dos compostos químicos covalentes, temos que usar a atração dos átomos em relação aos elétrons e tbm a eletronegatividade.
Um caso que te disse, a respeito do Difluoreto de Xenônio, nesse cara aqui, ele é tão instável que a qualquer alteração mínima de temperatura e/ou pressão, ele se dissolve. Logo, perceba Eduardo que, a força do flúor é muito grande, e ele quase consegue desestabilizar um gás nobre, como o xenônio...
Se vc ainda tiver dúvida, pode postar!
Pois, lembre-se daquela teoria lá dos compostos covalentes: os elementos compartilham os elétrons, só que há casos onde um elétron ficará mais perto do elemento X do que do Y. Isso ocorre devido a diferença de eletronegatividade entre eles. Até pq, se temos uma diferença de eletronegatividade maior, significa que eles teriam uma disputa maior.
E no caso do NO, tem uma diferença maior, logo, a disputa entre eles é menor... então o caráter covalente dele seria menor do que o do OF2. Eu te digo um conselho, lembre-se que na teoria dos compostos químicos covalentes, temos que usar a atração dos átomos em relação aos elétrons e tbm a eletronegatividade.
Um caso que te disse, a respeito do Difluoreto de Xenônio, nesse cara aqui, ele é tão instável que a qualquer alteração mínima de temperatura e/ou pressão, ele se dissolve. Logo, perceba Eduardo que, a força do flúor é muito grande, e ele quase consegue desestabilizar um gás nobre, como o xenônio...
Se vc ainda tiver dúvida, pode postar!

BatataLaranja345- Mestre Jedi

- Mensagens : 669
Data de inscrição : 09/07/2020
Idade : 19
Localização : Rio de Janeiro
Eduardo Rabelo gosta desta mensagem
 Re: Ligações Químicas.
Re: Ligações Químicas.
Cara, isso não faz sentido. Se a diferença de eletronegatividade é maior, um átomo vai atrair com mais intensidade a nuvem eletrônica, aumentando o caráter iônico da ligação. A dúvida do Eduardo é extremamente pertinente, e eu também não tinha entendido bem. Um colega tentou me explicar aqui. Mais tarde eu coloco a resposta dele.BatataLaranja345 escreveu:
E no caso do NO, tem uma diferença maior, logo, a disputa entre eles é menor... então o caráter covalente dele seria menor do que o do OF2. Eu te digo um conselho, lembre-se que na teoria dos compostos químicos covalentes, temos que usar a atração dos átomos em relação aos elétrons e tbm a eletronegatividade.

marcosprb- Mestre Jedi

- Mensagens : 825
Data de inscrição : 08/05/2017
 Re: Ligações Químicas.
Re: Ligações Químicas.
Ah entendi.
Então perdão pela explicação equivocada a respeito do assunto.
Pensei q havia ficado boa a justificativa da resposta.
Perdão novamente
Então perdão pela explicação equivocada a respeito do assunto.
Pensei q havia ficado boa a justificativa da resposta.
Perdão novamente

BatataLaranja345- Mestre Jedi

- Mensagens : 669
Data de inscrição : 09/07/2020
Idade : 19
Localização : Rio de Janeiro
 Tópicos semelhantes
Tópicos semelhantes» Ligações químicas - Estrutura e ligações do NO2
» Ligações Químicas
» (ITA) ligações químicas
» Ligações Químicas
» ligações químicas
» Ligações Químicas
» (ITA) ligações químicas
» Ligações Químicas
» ligações químicas
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|