Entalpia
2 participantes
PiR2 :: Química :: Físico-Química
Página 1 de 1
 Entalpia
Entalpia
(IME 1995) A partir da tabela a seguir:
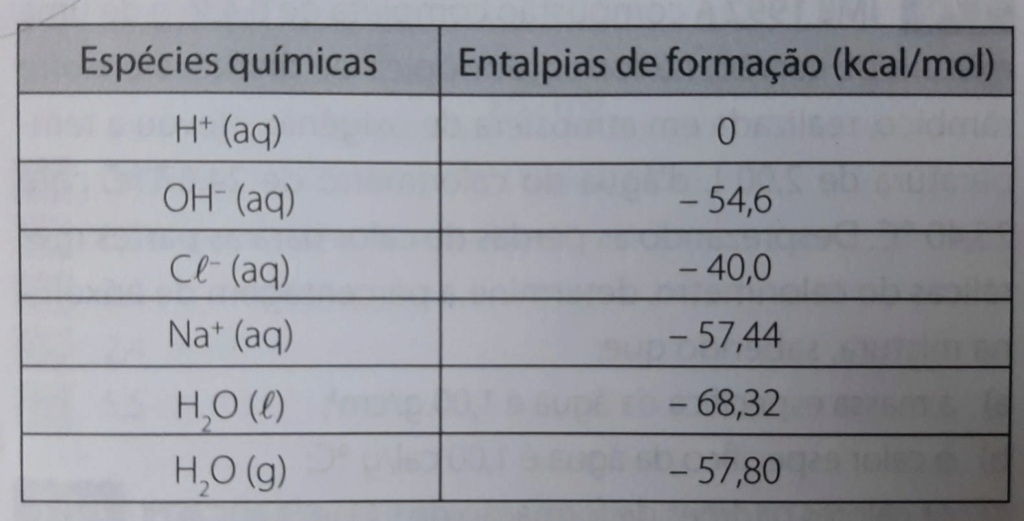
Determine a quantidade de calor liberado, quando se adicionam volumes iguais de uma solução 2 molal de HCl a outra, de concentração 2 molal de NaOH.
Para resolver essa questão não seria necessário a entalpa de formação do NaCl?

Determine a quantidade de calor liberado, quando se adicionam volumes iguais de uma solução 2 molal de HCl a outra, de concentração 2 molal de NaOH.
- Spoiler:
- Resp.: -13,72 kcal/mol de H2O
Para resolver essa questão não seria necessário a entalpa de formação do NaCl?
Nycolas- Padawan

- Mensagens : 66
Data de inscrição : 19/01/2023
Idade : 19
 Re: Entalpia
Re: Entalpia
A reação de neutralização completa é
\[\ce{HCl + NaOH -> NaCl + H2O}\]
Porém, em uma solução aquosa, temos a dissociação desses reagentes e produtos
\[\ce{H+ + Cl- + Na+ + OH- -> Na+ + Cl- + H2O}\]
Note que os íons \(\ce{Na+}\) e \(\ce{Cl-}\) são os chamados íons espectadores: eles permanecem dissociados na solução e não participam efetivamente da reação.
Dessa forma, como há íons \(\ce{Na+}\) e \(\ce{Cl-}\) em ambos os lados da reação, o que realmente está acontecendo nessa neutralização é a formação de água
\[\ce{H+ + OH- -> H2O}\]
O calor liberado ou absorvido em uma reação é a diferença entre as entalpias de formação dos produtos e as dos reagentes. Pela tabela do enunciado:
\[\Delta H=H_\text{p} - H_\text{r}\]
\[\Delta H=-68,\!32 - (-54,\!6)\]
\[\color{red}\Delta H=-13,\!72~\text{kcal/mol}\]
Esse calor foi liberado exclusivamente pela reação de formação de água.
Se o enunciado trouxesse os volumes das soluções que foram misturadas, poderíamos calcular o valor total da energia liberada. Como não trouxe, deixamos a resposta em termos genéricos de kcal/mol.
Uma discussão sobre essa reação está disponível em
\[\ce{HCl + NaOH -> NaCl + H2O}\]
Porém, em uma solução aquosa, temos a dissociação desses reagentes e produtos
\[\ce{H+ + Cl- + Na+ + OH- -> Na+ + Cl- + H2O}\]
Note que os íons \(\ce{Na+}\) e \(\ce{Cl-}\) são os chamados íons espectadores: eles permanecem dissociados na solução e não participam efetivamente da reação.
Dessa forma, como há íons \(\ce{Na+}\) e \(\ce{Cl-}\) em ambos os lados da reação, o que realmente está acontecendo nessa neutralização é a formação de água
\[\ce{H+ + OH- -> H2O}\]
O calor liberado ou absorvido em uma reação é a diferença entre as entalpias de formação dos produtos e as dos reagentes. Pela tabela do enunciado:
\[\Delta H=H_\text{p} - H_\text{r}\]
\[\Delta H=-68,\!32 - (-54,\!6)\]
\[\color{red}\Delta H=-13,\!72~\text{kcal/mol}\]
Esse calor foi liberado exclusivamente pela reação de formação de água.
Se o enunciado trouxesse os volumes das soluções que foram misturadas, poderíamos calcular o valor total da energia liberada. Como não trouxe, deixamos a resposta em termos genéricos de kcal/mol.
Uma discussão sobre essa reação está disponível em
tachyon- Iniciante
- Mensagens : 32
Data de inscrição : 20/02/2024
Localização : São Paulo, SP
 Re: Entalpia
Re: Entalpia
tachyon escreveu:A reação de neutralização completa é
\[\ce{HCl + NaOH -> NaCl + H2O}\]
Porém, em uma solução aquosa, temos a dissociação desses reagentes e produtos
\[\ce{H+ + Cl- + Na+ + OH- -> Na+ + Cl- + H2O}\]
Note que os íons \(\ce{Na+}\) e \(\ce{Cl-}\) são os chamados íons espectadores: eles permanecem dissociados na solução e não participam efetivamente da reação.
Dessa forma, como há íons \(\ce{Na+}\) e \(\ce{Cl-}\) em ambos os lados da reação, o que realmente está acontecendo nessa neutralização é a formação de água
\[\ce{H+ + OH- -> H2O}\]
O calor liberado ou absorvido em uma reação é a diferença entre as entalpias de formação dos produtos e as dos reagentes. Pela tabela do enunciado:
\[\Delta H=H_\text{p} - H_\text{r}\]
\[\Delta H=-68,\!32 - (-54,\!6)\]
\[\color{red}\Delta H=-13,\!72~\text{kcal/mol}\]
Esse calor foi liberado exclusivamente pela reação de formação de água.
Se o enunciado trouxesse os volumes das soluções que foram misturadas, poderíamos calcular o valor total da energia liberada. Como não trouxe, deixamos a resposta em termos genéricos de kcal/mol.
Uma discussão sobre essa reação está disponível em
Agora eu entendi!!
Obrigado. Deus abençoe.
Nycolas- Padawan

- Mensagens : 66
Data de inscrição : 19/01/2023
Idade : 19
PiR2 :: Química :: Físico-Química
Página 1 de 1
Permissões neste sub-fórum
Não podes responder a tópicos|
|
|













